
题目列表(包括答案和解析)
3.若NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.84gNaHCO3晶体中阳离子和阴离子总数为0.03NA
B.a gO2和O3的混合气体中所含分子数一定为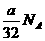
C.标准状况下,2.24L四氯化碳含碳原子数为0.1NA
D.1.8g H2O含有的质子数NA
2.以氮化硅(Si2N4)和氧化铝(Al2O3)为原料,采用高压烧结或热压工艺制备赛伦(Sialan)。赛伦的化学通式为Si6-xAlOxN8-x,以耐高温、高强度、超硬度、耐磨损、抗腐蚀等性能为主要特征,因此,在冶金、机械、光学、医学等领域有重要应用。它属于 ( )
A.金属材料 B.有机高分子材料
C.新型无机非金属材料 D.无机高分子材料
1.下列叙述正确的是 ( )
A.目前加碘食盐中主要添加的是KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品不是含任何化学物质的食品
D.在空气质量日报中CO2含量属于空气污染指数
25.(10分)将Cu与Fe2O3的混合粉末a g与1mol/L硫酸进行反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中无Fe3+,则
a= ,混合粉末中铜的质量为 。
(2)若将固体完全溶解于1.00L上述硫酸中,测得c(Fe3+)=0.1mol/L(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为 g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中既有Fe3+,也有Fe2+,则 a 的取值范围是 。
24、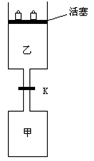 (8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V
L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)
(8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V
L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)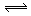 C(g)
C(g) +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
23、(10分)(1)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2+ + 4I– 2CuI↓+ I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈现蓝色,对这个现象解释正确的是:_____________(填序号)。
①阴极电极反应2H+ + 2e – H2↑,使c (OH – ) > c (H+)
②阳极2Cu + 4I – – 4e – 2CuI↓+ I2,I2遇淀粉变蓝
③阳极Cu – 2e – Cu2+,Cu2+ 显蓝色
④阳极2I – – 2e – I2,碘遇淀粉变蓝
(2)剪约6 cm长,2 cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2 cm),将铜片与铝片分别和电流表的“+”、“–”端相连结,电流表指针调到中间位置,取50 mL两只小烧杯,在一只烧杯中注入40 mL浓HNO3,另一只烧杯中注入40 mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为______(填“铝”或“铜”)极,铝片上的电极反应式为:____________________________。电流表指针偏向________(填“铝”或“铜”)
②两电极同时插入浓HNO3中,原电池的负极为_________(填“铝”或“铜”)极,铝片上的电极反应式为:_______________。电流表指针偏向________(填“铝”或“铜”)
22、(8分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是电子层数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐x;E与A同主族;A、B、C这三种元素,每一种与D都能形成元素的原子个数比不相同的若干种化合物。
(1)写出元素的名称:C____________________.E___________________
(2)画出D的原子结构示意图____________________________
(3)B的最高价氧化物的电子式是____________________________
(4)盐X的水溶液显酸性原因是___________________.(用离子方程式说明)。
21.有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是 。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 ,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通过直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若1.5×6.02×10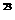 个电子转移时,该反应的化学方程式是
。
个电子转移时,该反应的化学方程式是
。
20. (10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
 (1)B的电子式为
,固体乙的化学式可能是
;
(1)B的电子式为
,固体乙的化学式可能是
;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式____________________________________________,
I和NaOH溶液反应的离子方程式________________________________________。
19.(8分)已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________;
(2)实验④中的现象为:_______________ ;
(3)实验②③反应的离子方程式分别是: _________________、_____________________ __。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com