
题目列表(包括答案和解析)
4.下列情况会对人体健康造成较大危害的是
A、用SO2漂白食品
B、自来水中通入少量Cl2进行消毒杀菌
C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D、 用小苏打(NaHCO3)发酵面团制作馒头
3.“纳米材料”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是
A、能全部透过半透膜
B、有丁达尔现象
C、所得液体一定能导电
D、所得物质一定为悬浊液或乳浊液
2.苹果汁是人们喜爱的饮料。由于饮料中含有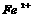 离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使
离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使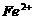 转变为
转变为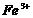 离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有
离子。若榨苹果汁时加入维生素C,会可有效防止这种现象的发生。这说明维生素C具有
A、氧化性 B、还原性 C、酸性 D、碱性
1.保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。其中有利于保护环境的是
A、①②④⑤ B、②③④⑥ C、①②④⑥ D、③④⑤⑥
22.(8分)如图所示
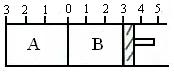
某容器分隔成A、B两部分,A容积固定不变,B有可移动的活塞,现在A中通入2molSO2和1molO2,在B中通入2molSO3和1molN2,在相同温度下均发生反应:
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
请根据下列要求填写空白:
(1)如果活塞位于3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA和PB的关系是PA______PB(填“<”、“>”或“=”)
(2)若要使A中与B中平衡状态相同,活塞左端应处于刻度________处。
(3)若活塞左端移到刻度5处,达平衡后,B中SO3为xmol,A中SO3为ymol,则x和y关系为x_____y(填“<”“>”或“=”)。理由是:__________________________
23(8分)铜是重要的工业原材料,现有Cu、Cu2O、CuO组成的混合物,某研究性学习小组为了探究其组成情况,向混合物中加入1L0.6mol·L-1HNO3溶液刚好使其溶解,同时收集到2.24LNO气体(标准状况)。通过计算回答下列问题(写出解题过程)
(1)产物中硝酸铜的物质的量。
(2)如混合物中Cu的物质的量为x,则x的取值范围为
21.(14分)(1)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。试回答:
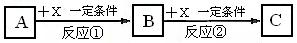
①若X是强氧化性单质,则A不可能是________。
a. S b. N2 c. Na d. Mg
②若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为_____________________________;C溶液在贮存时应加入少量X,理由是(用必要的离子方程式表示)____________________________________,检验此C溶液中金属元素价态的操作方法是___________________________________。
(2)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物:Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。请回答:
①Z2Y的化学式是___________________________。
②Z2Y2与X2Y反应的化学方程式是:_____________________________________。
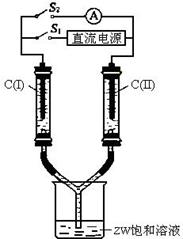 ③如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成,一段时间后(两玻璃管中液面脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(I)的电极名称是________(填写正极或负极);电极反应式是:_______________________;C(II)的电极反应式是____________________________________。
③如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)、C(II)为多孔石墨电极。接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成,一段时间后(两玻璃管中液面脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(I)的电极名称是________(填写正极或负极);电极反应式是:_______________________;C(II)的电极反应式是____________________________________。
④铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是:_____________________________________。
20.(12分)为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如下图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
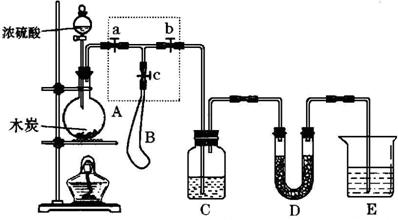
请回答下列问题:
(1)实验前应首先检查装置A的气密性,可以采取的操作是
______________________________________________________________________________
______________________________________________________________________________
(2)C、E两处装置中应盛放的试剂分别为:C________________;E______________;
(3)此实验成功的关键在于控制反应产生的气体通过C、D、E三个装置的速率不能过快,由此设计一个虚框部分的装置,则对于下列三步操作正确的先后顺序是(用操作编号填写):___________________。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中的气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为___________________________________________。
(5)当D装置的右管的产生__________________________________________现象且E中出现___________________________________现象时,可以充分说明产生的气体中有CO2。装置D的作用为_______________________________。
19.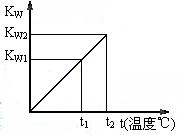 (12分)水的离子积常数KW与温度t(℃)的关系如右图所示:
(12分)水的离子积常数KW与温度t(℃)的关系如右图所示:
(1)若t1=25℃,则KW1=_______;若t2=100℃时,KW2=
10-12,则0.05mol·L-1的Ba(OH)2溶液的pH=_______。
(2)已知25℃时,0.1L0.1mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的化学平衡有(用离子方程式表示):_______________。溶液中各离子的物质的量浓度由大到小的顺序为________________。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为___________。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强碱的pH(pH酸)与强碱的pH(pH碱)之间应满足的关系为:
pH(酸)+pH(碱)=_______________。
18.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下所体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是( )
A.6g B.8g C.10g D.12g
第II卷(非选择题 共54分)
17.按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
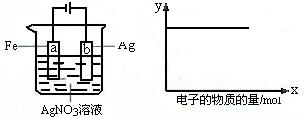
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com