
题目列表(包括答案和解析)
22.(10分)H是一种香料,可用下图的设计方案合成。

已知:① 在一定条件下,有机物有下列转化关系:
② 在不同的条件下,烃A和等物质的量HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F。
⑴ D的结构简式为 。
⑵ 烃A→B的化学反应方程式是 。
⑶ F→G的化学反应类型为 。
⑷ E+G→H的化学反应方程式 。
⑸ H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是
。(用结构简式表示)
21.(本题共14分)工业接触法制硫酸的流程如下图所示:
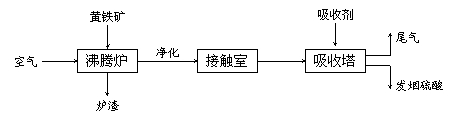

(1)写出沸腾炉中发生反应的化学方程式:
。
(2)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成是:SO2 7 %,O2 11 %,N2 82 %。从接触室出来的气体中SO3的体积分数为7 %,则SO2的转化率为 。
(3)接触室采用常压而不采用高压的原因是__
。
(4)在吸收塔中为什么用98.3 %的浓硫酸而不是用水吸收SO3?
。
每100 g SO3气体与H2O完全反应放出热量162.9 kJ,该反应的热化学方程式为
。
(5) 某硫酸厂每天用含FeS2 60%的硫铁矿500 t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%。每天能生产98%的硫酸___ ______吨。
20. 用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL 0.3mol/L NaCl溶液和300mL 0.2 mol·L-1的AgNO3溶液,当产生0.56 L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液的pH为(设混合后总体积为500 mL)
A、1.4 B、5.6 C、12.6 D、7
第II卷(非选择题 共60分)
19. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
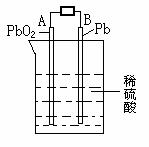 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
则下列说法正确的是:
A.充电时:阳极反应是4OH--4e-=O2↑+2H2O
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.放电时:电子流动方向由B到A
18.“类推”是一种常用的学习方法,但有时类推会产生错误的结论,下列类推结论中正确的是
A.NH4Cl加热分解只生成HCl和NH3,NH4I固体加热分解也只生成HI和NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3,则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.溶液中有阳离子,必有阴离子,则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体
17.用两支惰性电极插入CuSO4溶液中,通电电解,当有1×10-3molOH-放电时,溶液颜色变浅,则下列叙述正确的是
A.阳极上析出5.6 mL O2(标准状况) B.阴极上析出64 mg Cu
C.阴极上析出11.2 mLH2(标准状况) D.阳极和阴极质量都无变化
16. 下列关于晶体的说法一定正确的是
A.离子晶体在水中的溶解度一定比分子晶体的大
B.分子晶体中都存在共价键和分子间作用力
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.在氯化钠晶体中每具氯离子同时吸引6个钠离子
15. NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,32 g O2和O3的混合气体所含原子数为2 NA
B.1 mol Cl2参加氧化还原反应,转移的电子数目一定是2 NA
C.1 L 1 mol/L CuCl2溶液中含有的Cu2+的个数为 NA
D.20℃、1.01×105 Pa时,2.24 L C2H4和CO的混合气体,含气体分子数为0.1 NA
14. 在测定硫酸铜晶体里结晶水含量的实验中,下列操作会引起测量结果偏小的是
A.加热前称量时坩埚未完全干燥 B.加热时间过长,晶体部分变黑
C.加热过程中有少量晶体溅出YCY D.粉末未完全变白就停止加热
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得
ClO2:2KClO3+H2C2O4+H2SO4
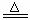 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
A.KClO3 在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.1 mol KClO3 参加反应有2 mol 电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com