
题目列表(包括答案和解析)
7. 设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
6. 常温下,下列溶液中一定能大量共存的离子组是
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
5. 下列离子反应方程式正确的是
A.澄清石灰水来吸收氯气:Cl2+OH-=Cl-+ClO-+H+
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
4、膳食中的钠主要存在于食盐中,它是烹饪中重要的调味品,也是保证肌体水分平衡的最重要物质。钠缺乏症可造成生长缓慢、食欲 减退、由于失水体重减轻、肌肉痉挛、恶心、腹泻和头痛。膳食中长期摄入过多的钠将导致高血压。这里涉及到的钠指的是 ( )
A.钠单质 B.食盐 C、钠离子 D.碳酸氢钠
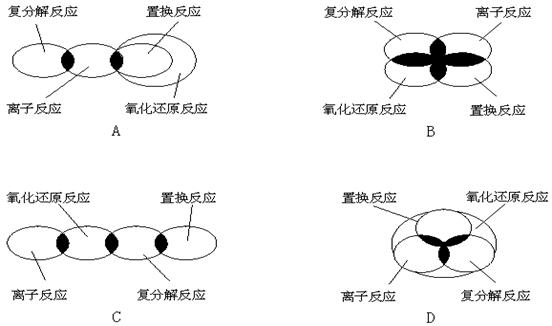
3、离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是:( A )
2. 请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A、 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B、 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 、 一定条件下,金属钠可以成为绝缘体
D 、 一定条件下,水在20℃时能凝固成固体
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
25. (11分) A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期,A与B组成的化合物甲为气态,其中A、B原子个数比为4∶1。由A与C组成的两种化合物乙与丙均为液态,乙中A、C原子个数比为1∶1,丙中为2∶1。由D与C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1∶1,戊中为2∶1。
(1)下列分子的电子式为:
甲 _______________ ;乙_______________ ;戊________________
(2)写出B元素最高价氧化物与丁发生反应的化学方程式: _____。
(3)由A、B、C、D四种元素形成的化合物中,有一些化合物的水溶液呈碱性。从已学过的化合物中试写出两种,并用离子方程式表示其呈碱性的原因。
1___________;_____________________________。
2____________; ________________________。
24.(12分)某学习小组从海带中提取单质碘,实验步骤如下:
(1)实验室焙烧海带,需要下列仪器中的_______________________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三角架 f.酒精灯
(2)将所得海带灰加水溶解、过滤,所需的玻璃仪器是________________________。
 (3)在滤液中检出了I-,还检出了K+,检验K+的操作步骤是_________
。
(3)在滤液中检出了I-,还检出了K+,检验K+的操作步骤是_________
。
(4)小组同学查阅了有关资料,氧化性由强到弱的顺序为:Cl2 > IO3- >H2O2 > I2,他们决定用H2O2做氧化剂,不用Cl2的原因是_________________;反应中I-转化为I2,H2O2转化为__________________________。
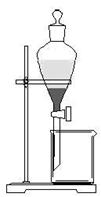
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_____________________________。
(6)根据以下数据推断:
①已知SiCl4的沸点为57.6℃,则CCl4的沸点____________(填“高”或 “低”)于57.6℃。
②已知I2的沸点为113.6℃,熔点为185.2℃,从碘的CCl4溶液中分离出碘单质,应采用的方法是_______(填序号)。
a.过滤 b.升华 c.蒸发 d.蒸馏
23.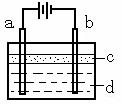 (本题共13分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
(本题共13分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁:
(1)a极材料为 ,
电极反应式为 。
(2)电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是 ,在加苯之前对d溶液进行加热煮沸处理,目的是 _____________ 。
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com