
题目列表(包括答案和解析)
6. U是重要的核工业原料,在自然界的丰度很低。 U的浓缩一直为国际社会关注。下列有关 U说法正确的是
A U原子核中含有92个中子 B U原子核外有143个电子
C U与 U互为同位素 D U与 U互为同素异形体
5. 物质的量浓度相同时,下列既能与NaOH溶液反应、又能跟盐酸反应的溶液中,pH最大的是
A Na2CO3溶液 B NH4HCO3溶液 C NaHCO3溶液 D NaHSO4溶液
4、氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟
B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应
D、生成1molN2有6mol电子转移
3、下列说法正确的是
A、硅材料广泛用于光纤通讯
B、工艺师利用盐酸刻蚀石英制作艺术品
C、水晶项链和餐桌上的瓷盘都是硅酸盐制品
D、粗硅制备单晶硅不涉及氧化还原反应
2.下列叙述正确的是
A、 日常生活中无水乙醇常用于杀菌消毒
B 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
C、目前加碘食盐中主要添加的是KIO3
D、在PH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在阴离子Cl- 、NO3- 、SO42-
1、许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
22.A、B、C、D为短周期元素。A元素原子的次外层电子数是最外层电子数的1/2,B的阴离子核外只有一个电子层,C单质在标态下的密度为1.43g/L,D元素的焰色反应呈黄色。将以上四种元素组成的结晶水盐3.4g加热到完全失去结晶水,其质量减少1.35g,所得无水盐中C元素的质量分数为39%。将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧得0.9g水和1.12L(标)CO2,已知这种弱酸一个分子中共有32个质子。回答:
(1)四种元素各是什么元素,A______,B _____,C______,D_______。
(2)结晶水盐的化学式: ____________________________________________。
化 学 试 卷  答 题 卡
答 题 卡

|
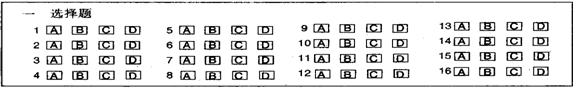
17.(8分) (1) _______________ (2) ______________ (3) _______________ (4) ______________ 18.(6分) (1) __________________________________________________________________ (2) ________________ _________________ __________________ (3) ________________ 19.(10分) (1) A_____________ C_____________ D_____________ E_____________ (2) ___________________________ 20.(8分) (1) _________________________ (2) ________________________________________________ (3) ⑤_____________________________________________________ ⑥_____________________________________________________ 21.(10分) (1) _____________________________________ (2) _________________,___________________________________________ (3) __________________________________________________ (4) ___________________________________________________ 22.(10分) (1) A_____________ B_____________ C_____________ D_____________ (2) ___________________________ |
21. (10分)为探究SO2和NaOH溶液确实发生了化学反应,某实验小组的同学设计了下列三种实验装置。
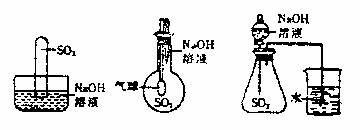
(1)写出SO2与过量NaOH溶液反应的离子方程式:________________________ ;
(2)从实验装置I、II、III中任意选择一种,简述出现的实验现象:选择的实验装置是________,实验现象为________________________________________;
(3)某同学质疑上述实验设计,该同学质疑的依据是_______________________;
(4)设计最简单的实验,证明实验I的试管中SO2和NaOH肯定发生反应______
____________________________________________________________________。
20.(8分)下图是中学化学常见物质之间的相互转化关系(部分生成物略去),反应①-⑥均为氧化还原反应。其中C、D在常温下是气体单质,其余均为化合物;常温下D是一种黄绿色气体,B是一种无色液体,A、E、G、H的焰色反应呈紫色,且A、G、H含有相同的两种元素,反应⑤生成的A与H的物质的量之比为1∶3。
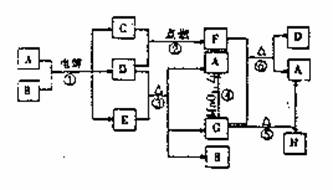
请回答下列问题:
(1)写出A的电子式:_______________ 。
(2)常温常压下,若1 mol气体F完全分解需要吸收92.3kJ热量,则气体C在气体D中燃烧的热化学方程式为 _______________________________________。
(3)写出下列反应的化学方程式:
⑤______________________________________________
⑥______________________________________________
19.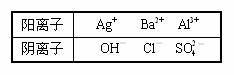 (10分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
(10分)现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阳离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。请根据上述实验结果,填空:
(1)写出化合物的化学式:
A____________,C ____________,D ___________,E _____________ ;
(2)A溶液与过量的E溶液反应后,最终得到的沉淀的化学式是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com