
题目列表(包括答案和解析)
21. (12分)由A、D、E、G四种元素组成的化合物的分子式为AxDy(E2G4)z。
已知:(1)x、y、z为整数,且x+y+z=7。
(2)取8.74g该化合物溶于水,加入酸和强氧化剂,化合物中的E、G元素完全转化成气态化合物EG2 2.688L(标准状况下),其密度为1.965g/L,EG2能使澄清石灰水变浑浊。
(3)发生上述反应后,A、D以阳离子存在于溶液中,往溶液里加入过量的铁粉,其中使D离子全部还原所消耗的铁粉质量为0.56g。
(4)化合物中D元素的百分含量为12.8%。
试通过计算和推理确定E、G、D、A各是什么元素,求出x、y、z的值,并写出该化合物的分子式(注意:请按指定位置进行计算和推理)。
解:(1)确定E和G:E是_______;G是_____________。
(2)确定x、y、z和D:x=_________,y=__________,z=__________;D是_______________。
(3)确定A并写出化合物的分子式:A是__________;该化合物的分子式是______________。
20. (12分)白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙3份质量不同的A样品分别与50.0mL相同浓度的盐酸充分反应,得到气体的体积(标准状况)与A的质量关系如下表:
|
实验组别 |
甲 |
乙 |
丙 |
|
稀盐酸的体积(mL) |
50.0 |
50.0 |
50.0 |
|
A样品的质量(g) |
2.84 |
5.25 |
7.00 |
|
气体的体积(L) |
0.672 |
0.896 |
0.896 |
试计算:
(1)该盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
19. (12分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,
A、F所含元素同周期,则反应①的化学方程式是_______________________________________。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是_____________________________________________。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是_________________,
反应③的化学方程式是__________________________________________。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是__________________,反应④的化学方程式是___________________________________。
18. (12分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
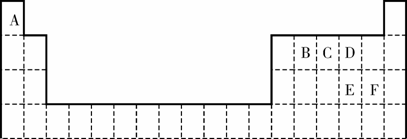
(1)B和E的最高价氧化物对应的水化物中酸性较强的是________________。(填化学式)
写出可以验证该结论的一个离子反应方程式______________________________________。
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3,还有反应生成的Cl2和NOCl。假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式_______________________。
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式:____________________________________________。
17. (10分)某研究性学习小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应
③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(1)该小组“实验室制Si”的化学方程式是____________________________。
(2)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是______________________
___________________________________________________________________________________________________________________________________________________________________________。
16. (8分)现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有____________,处于第二周期的有_________(以上均用编号表示)。
(2)上述元素中金属性最强的是____________(用编号表示),写出其原子的电子排布式_____________。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式______________________。
(4)写出元素⑦形成单质的电子式_____________,画出元素②形成的简单离子的结构示意图:________________。
(5)写出由上述元素形成的10电子微粒的微粒符号____________________。
15. (6分)据报道,在全国各地发生了多起因洁污剂混合放出氯气而中毒的事件,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。请根据你的化学知识作出如下推断(这一推断的正确性有待证明):
(1)当事人使用的液态洁污剂之一必定含氯元素,若可能存在的离子组合是ClO-和Cl-或者ClO3-和Cl-,则当另一种具有_____________(填“酸性”、“碱性”或“中性”)的液态洁污剂与之混合,可能发生反应而产生氯气。
(2)写出ClO-和Cl-可能发生的反应的离子方程式__________________________________。
(3)若反应转移了0.5mol的电子,则ClO3-和Cl-可能发生的反应产生的氯气在标准状况下体积为________________。
14. 将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为()
A. 6.72 B. 1.12 C. 1.00 D. 0.986
第Ⅱ卷(非选择题共72分)
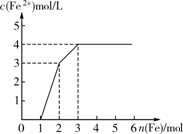
13. 现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝 酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间关系如右图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为()
A. 1∶1∶1 B. 1∶3∶1 C. 3∶3∶8 D. 1∶1∶4
12. 有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
|
① |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr 151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(b)58.7 |
I2 184.0 |
|
③ |
(c)19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O 100.0 |
H2S -60.0 |
(d)-42.0 |
H2Te -1.8 |
|
⑤ |
CH4 -161.0 |
SiH4 -112.0 |
GeH4 -90.0 |
(e) -52.0 |
对应表中内容,下列叙述中正确的是()
A. a、b、c的化学式分别为Ne、Br2、HF
 B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C. 系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D. 上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com