
题目列表(包括答案和解析)
19.氮化铝(AlN)具有耐高温、抗冲击、导电性能好等优良性能,被广泛应用于电子工业、陶瓷工业等领域,在一定条件下,氮化铝可通过如下反应合成
Al2O3+N2+3C===2AlN+3CO,下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2mol AlN,电子转移3mol
C.氮化铝晶体属于分子晶体
D.氧化剂与氧化产物的物质的量比为1∶3
18.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n (X) = 2∶3∶1∶3∶1,则X可能为 ( )
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
17.已 知化学反应C(s)+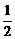 O2(g)==CO(g);△H=
- Q1 kJ/mol,
O2(g)==CO(g);△H=
- Q1 kJ/mol,
2CO (g)+O2(g)==2CO2(g);△H= - Q2 kJ/mol。
据此推断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同) ( )
A.碳的燃烧热为Q1 kJ/mol
B.2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量
C.一定质量的碳燃烧,生成CO2(g)比生成CO(g)时放出的热量多
D.碳燃烧生成CO2气体的热化学方程式为:
C(s)+ O2(g)==CO2(g);△H= -(Q1 +Q2)kJ/mol
16.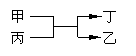 甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下
甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物,它们存在如下
转化关系, ,满足条件的甲和乙为 ( )
A.铝和铁 B.氟气和氧气 C.碳和硅 D.镁和碳
15.碳与浓硫酸共热产生的气体X和铜与浓硝酸反应产生气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如右图装置),下列说法正确的是( )
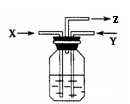 A.洗气瓶中会产生碳酸钡沉淀
A.洗气瓶中会产生碳酸钡沉淀
B.在Z导管出来的气体中无二氧化碳
C.在Z导管口有红棕色气体出现
D.洗气瓶中会产生亚硫酸钡沉淀
14.下列离子方程式,正确的是 ( )
A.Ca(ClO)2溶液中通入少量SO2气体:
H2O +SO2 + Ca2+ + 2ClO- === CaSO3↓+ 2HClO
B.向NH4HCO3 溶液中加入足量Ba(OH)2溶液
NH4+ +HCO3- + 2OH- === H2O + CO32- + NH3·H2O
C.向FeCl2溶液中加足量溴水
2Fe2+ + Br2 === 2Fe3++ 2Br-
D.NaAlO2溶液中通入过量CO2
2AlO2- +CO2+3H2O===2Al(OH)3↓+CO32-
13.某溶液中含有下列六种离子,①HCO3-、②SO32-、③Na+、④CO32-、⑤NH4+、⑥NO3-,向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A.①②④⑤ B.②③④ C.③④⑥ D.只有⑥
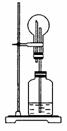
12.在右图所示的装置中,烧瓶中盛有空气,广口瓶中盛
放下列物质时不能发生喷泉的选项 是 ( )
A.纯碱和稀硫酸
B.NaOH固体和浓氨水
C.Na2O2和NaOH溶液
D.Cu与浓硫酸
11.用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.1.8g重水(D2O)中含有的中子数为NA
B.常温常压下,31g白磷含有NA个磷原子
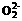 C.1mol 中含有电子数为16NA
C.1mol 中含有电子数为16NA
D.标准状况下,22.4L单质溴所含有的原子数目为2NA
9.三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子呈三角锥形,以下关于NCl3的叙述正确的是 ( )
A.NCl3形成的晶体为原子晶体
B.分子中N-Cl键是非极性共价键
C.NCl3是一种含极性键的极性分子
D.N-Cl键能小,故NCl3沸点低
|
A.铁与硫反应生成硫化亚铁,而铁与氯气反应时生成氯化铁
B.与金属钠反应,氯原子得一个电子,而硫原子能得两个电子
C.常温时氯气呈气态,而硫呈现固态
D.氯的最高价为+7价,而硫的最高价为+6价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com