
题目列表(包括答案和解析)
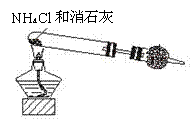
29.(18)资料显示:“氨气可在纯氧中安静燃烧,……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
Ⅰ

Ⅱ
(1)若用装置Ⅰ制取纯净、干燥的氨气,大试管发生的反应化学方程式是 ,干燥管中盛装的物质是 。
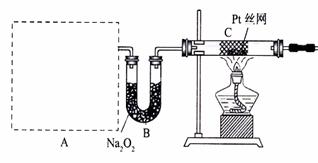
(2)若按装置Ⅱ进行实验,A处是气体发生装置,A中所用实验药品从下列物质中选取:(a)Na2CO3 (b)NaHCO3 (c)NH4HCO3 (d)NH4Cl (e)Ca(OH)2 (f)浓氨水, 要求进入装置C(Pt丝网作催化剂)中的气体是氨气与纯净的氧气,加热发生反应。
回答下列问题:
①若A中制取气体时只用一种药品,该药品为 (填备选药品的序号)。
②B装置的作用为 。
③写出C中发生反应的化学方程式
④反应发生后,装置D中气体变为红棕色,则装置E中Cu片发生的反应离子方程式为 。
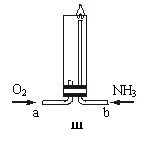 (3)将过量的纯氧与装置Ⅰ产生的氨气分别从a、b
(3)将过量的纯氧与装置Ⅰ产生的氨气分别从a、b
两管进气口通入到装置Ⅲ(见右图)中,并在b
管上端点燃氨气,氨气安静燃烧并生成无污染物
质,则:
①两气体通入的先后顺序是 ,
其理由是 。
 ②氨气燃烧的化学方程式是
②氨气燃烧的化学方程式是
28.(13分)
(1)已知下列反应在一定条件下可以发生:
H2O2 + 2Fe2+ + 2H+ == 2Fe3+ + 2H2O
H2O2 + 2Fe3+ == 2Fe2+ + O2↑+ 2H+
在以上反应中Fe2+实际上起着 作用,总反应式为
(2)I2与Fe2+一样也能发生上述类似反应,类比(1)写出合适的化学反应方程式:
H2O2 + I2 == 2HIO ,总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,溶液呈棕色,并可以使淀粉溶液变蓝,写出该反应的离子方程式 ,
反应过程中同时还放出大量的无色气体A2,请说明A2是何物质,它是如何生成的? 。
有同学认为上述棕色溶液和无色气体A2的生成,可用一个离子方程式表示为:
H2O2 + 2I- === I2 + A2↑+2H+,请用氧化还原反应知识判断该方程式的正误并说明理由(若认为正确,不必说明理由) 。
27.(13分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。有的反应中反应物和生成物未全部给出,反应条件也未注明。
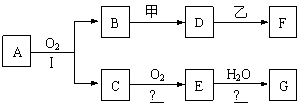
(1)若A为硫酸工业的重要原料,C能使品红褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成,A和乙含一种相同的元素。则
①A的的化学式为 ,工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
②用烧碱溶液检验F溶液中所含阳离子时观察到的现象为
其中发生了氧化还原反应的化学方程式为
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①写出B和甲反应的化学方程式_______________________。
②写出D溶液与乙反应的离子方程式
③E→G的化学方程式: ________________________________________。
26.(16分)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A是 ,D是 , E是 。
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式 ,写出一种含非极性键的离子化合物的电子式 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的电子式是 ,
该物质与E的同周期相邻主族元素的单质反应的化学方程式为
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为 。
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式
25.已知0.2molCu2S与200mL 6.5mol/L的硝酸恰好完全反应,生成硝酸铜、硫酸、水和一种含氮物质,则该含氮物质的化学式为 ( )
A.N2O B.NO C.NH4NO3 D.NO2
|
24. H2SO4、Al2(SO4)3和MgSO4的混合溶液
H2SO4、Al2(SO4)3和MgSO4的混合溶液
中,加入NaOH溶液时,其沉淀的质量
W和加入的NaOH体积V之间的关系
如图所示,则原混合溶液中Al3+、Mg2+
和SO42-的物质的量之比为 ( )
A.1∶1∶1 B.5∶3∶2
C.2∶1∶5 D.3∶2∶2
23.在一定条件下,RO3-与R-可发生反应:RO3- +5R- +6H+===3R2+3H2O。下列关于R元素的叙述中,正确的是 ( )
A.R元素位于周期表中ⅤA族 B.R原子最外层有7个电子
C.RO3-中的R只能被还原 D.R2在常温常压下一定是气体
22.几种短周期元素的主要化合价及原子的原子半径数据见下表:
|
元素代号 |
L |
M |
Q |
|
T |
||
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+7、-1 |
-2 |
||
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.099 |
0.074 |
据表中信息判断,下列有关叙述中,正确的是 ( )
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.M与T形成的化合物能和强酸、强碱反应
C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物
D.L与R两元素形成的化合物中,含有共价键
21.下列画有横线的物质,在反应中能被完全消耗的是 ( )
A.将含少量H2O(g)的H2通过盛有足量Na2O2容器中,并不断用电火花点燃
B.将1molCu置于含2molH2SO4的浓硫酸中加热
C.将相同条件下的等体积的NO和O2混合后通入足量水中充分反应
D.将2molSO2和4molO2投入450℃并盛有催化剂的密闭容器中反应
20.下列化合物中,不能通过化合反应而得到的是 ( )
A.SO3 B.NaHCO3 C.Al(OH)3 D.Fe(OH)3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com