
题目列表(包括答案和解析)
6.下列离子方程式书写正确的是 ( )
A.铝与烧碱溶液反应:Al+2OH-=AlO2-+H2↑
B.碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.CO2气体通入次氯酸钙溶液中:CO2+2ClO-+H2O=CO32-+2HClO
 D.氯化铁溶液呈酸性:Fe3++3H2O Fe(OH)3+3H+
D.氯化铁溶液呈酸性:Fe3++3H2O Fe(OH)3+3H+
5.下列各条件下可能共存的离子组是 ( )
A.某无色溶液中:NH4+、Na+、Cl-、MnO4-
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、、K+、SO32-、CO32-
C.在c(H+)=11×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
4.用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.0.2mol过氧化氢完全分解转移的电子数目为0.4NA
B.1mol C8H18中含有的共价键为26NA
C.在常温常压下,17g硫化氢所含质子数目为8NA
D.在标准状况下,2.24L二氧化硫与氧气混合气体中所含氧原子数为0.2NA
3.下列事实不能用勒夏特列原理解释的是 ( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.将FeCl3溶液加热蒸干最终得不到FeCl3固体
C.实验室用排饱和食盐水的方法收集氯气
D.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
2.下列实验方法正确的是 ( )
A.用渗析的方法精制氢氧化铁胶
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.测定溶液pH,用玻璃棒蘸取原溶液点在润湿的pH试纸上立即与比色卡比较
D.测定硫酸铜晶体中结晶水含量,实验过程中至少需要三次称量
1. 判断下列有关化学基本概念的依据正确的是 ( )
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
23.(7分)已知CuO在高温下用H2还原,可生成Cu,也可能有Cu2O生成。当H2足量时,生成的Cu2O在高温下用H2还原,可生成Cu,也可能有Cu2O生成。当H2足量时,生成的Cu2O也能被H2还原成Cu。
|
①写出H2 Cu+H2O,②
,
③ 。
(2)Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸和稀硝酸四种试剂。简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否有Cu2O。
。
(3)若将10.0gCuO在高温下与H2发生反应,反应结束后测得剩余固体质量为8.4g,则反应过程中转移电子物质的量为 。
(4)若有a g CuO和Cu2O的混合物,加入2.0mol/L H2SO4V mL,使混合物恰好全部反应,则V的取值范围为 。
22. (11分)某校化学课外小组同硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
(11分)某校化学课外小组同硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:


请根据题目要求回答下列问题:
(1)A的化学式为 ,上述操作过程中用到的玻璃仪器有:①烧杯、
②玻璃棒、③酒精灯、④温度计⑤ 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是 。
(4)已知硫酸亚铁铵[(NH4)2Fe(SO4)2]比硫酸亚铁稳定,常用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式 。
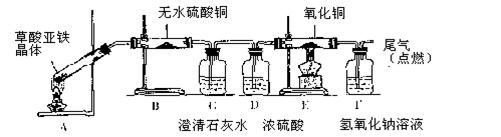 (5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置实验开始后,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生
(填化学式,下同);反应后A处试管中有黑色固体粉末(混合物)产生,倒出时有燃烧现象。A处试管中黑色固体粉末可能是 。
6.52g加热到完全反应后,气体产物通过浓硫酸增重1.71g,剩余气体通过碱石灰增重1.10g,则混合物中W的质量为 ,N·xH2O的化学式为 。
21.(7分)X、Y、Z、W和N均是由短周期元素组成的五种化合物。已知五种化合物水溶液的焰色反应呈黄色,Y、Z和N均由三种元素组成。请根据题目要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有化学键有 (填序号)
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式 。
(3)下表为Y与Z实验的部分内容
|
序号 |
主要实验步骤及实验现象 |
|
① |
在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色。 |
|
② |
在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现了白色沉淀。 |
|
③ |
将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体。 |
写出Y与稀硫反应的离子方程式 。
(4)写出含0.1molZ的溶液与20mL5mol/L的盐酸反应的离子方程式
。
实验③加热蒸发、灼烧得到的最终产物主要是 。

(5)化合物W和N可以相互转化,W N。若有W和N·xH2O的混合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com