
题目列表(包括答案和解析)
5.2008年夏季奥运会将在我国举行。奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷撞击发生的化学反应为:5KC1O3+6P 3P2O5+5KC1。下列有关该反应的叙述中,正确的是 ( )
A.反应中红磷是氧化剂
B.发令时产生的白烟只是KC1固体颗粒
C.“火药”中的红磷可以用白磷代替
D.反应中消耗3molP时,转移电子的物质的量为15mol
4.在0.5L某浓度的NaC1溶液中含有0.5molNa+,下列对该溶液的说法中,不正确的是( )
A.该溶液的物质的量浓度为1mol·L-1
B.该溶液中含有58.5gNaC1
C.配制100mL该溶液需用58.5NaC1
D.量取100mL该溶液倒入烧杯中,烧杯中C1-的物质的量为0.1mol
3.某同学效游不慎被蜜蜂蛰伤,已知蜜蜂蛰人时分泌的液体是酸性的。该同学随身携带的物品有苹果汁、牛奶、矿泉水和香皂等,其pH分别为a、b、c、d(如图所示,d为香皂水的pH),为了减轻蛰伤处的疼痛,应涂抹 ( )

A.苹果汁 B.牛奶 C.矿泉水 D.香皂水
2.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别指 ( )
A.纤维素,脂肪 B.蛋白质,烃
C.淀粉,油脂 D.蛋白质,硬化油
1.下列有关叙述正确的是 ( )
A.“神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐”“含氟牙膏”“富硒营养品”“高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C.赤潮、酸雨、臭氧层空洞、潮汐等都与环境污染有关
D.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
31.自然界存在着一种白云石的矿石,其化学式是xCaCO3·yMgCO3。以它为原料,可制取耐火材料等。
(1)称取27.6g白云石,加热到质量不再变化,可以生成耐火材料MgO多少mol?(用x、y的代数式表示)
(2)若在上述反应中,收集到CO26.72L(标准状况下),试写出白云石的化学式(取x、y的最小正整数比)。
(3)若把收集到的6.72LCO2用NaOH来吸收,将CO2通入200mL2.25mol·L-1NaOH溶液中,充分反应后,试确定溶液中CO2-3和HCO-3的物质的量之比(不考虑离子的水解)。
(4)若称取白云石mg,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a,生成VL(标准状况)一氧化碳。试计算V为多少L(标准状况)?(用m、a代数式表示)
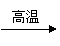
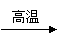
(已知CaO+3C CaC2+CO;2MgO+5C Mg2C3+2CO)
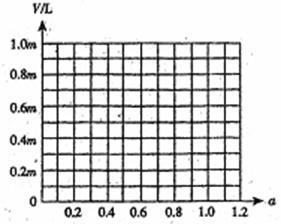 请在下图中画出V和a的关系图。
请在下图中画出V和a的关系图。
30.化合物KzFe(C2O4)y·zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol·L-1H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL0.0500mol·L-1KMnO4溶液完全反应。
已知:2KMnO4+5H2C2O4+3H2SO4→2MnSO4+K2SO4+10CO2↑+8H2O
MnO-4+5Fe2++8H+→Mn2++5Fe3++4H2O
通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物的化学式。
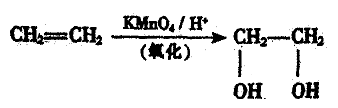 28.有机玻璃是甲基丙燃酸甲酯的聚合物,已知烯烃可被酸性高锰酸钾溶液氧化成二元醇,如:
28.有机玻璃是甲基丙燃酸甲酯的聚合物,已知烯烃可被酸性高锰酸钾溶液氧化成二元醇,如:
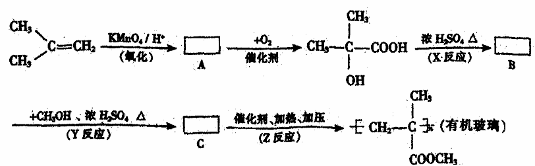 现以2-甲基丙烯为原料,通过下列合成路线制取有机玻璃。
现以2-甲基丙烯为原料,通过下列合成路线制取有机玻璃。
请回答下列问题:
(1)写出结构简式:
A: ;B: ;C: 。
(2)写出反应类型:
X反应 ;Y反应 ;Z反应 。
29.蜂皇酸是峰王浆的主要活性成分之一,具有灭菌、防辐射、防脱发、抗癌等多种生理功能,蜂皇酸的含量是评价蜂王浆质量的重要指标。蜂皇酸Q中含碳、氢、氧三种元素,其中碳的质量分数为65.2%,氢的质量分数为8.7%;Q具有酸性,1molQ需要1molNaOH完全中和;1molQ可以和1molBr2加成,经测定Q的相对原子质量不大于200。各有机物的转化关系如下图所示:
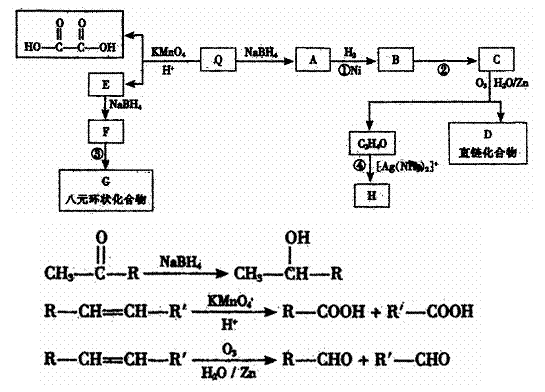
已知
请回答下列问题:
(1)写出Q的分子式 ;Q的结构简式 ;Q在转化过程中能发生氧化反应的官能团为 。
(2)写出反应类型:反应① ;反应④ 。
(3)写出反应条件:反应② ;反应③ 。
(4)写出和D含有相同官能团的同分异构体的结构简式 (任意写一种)
(5)写出和E互为同系物的物质的结构简式 (任意写一种)。
(6)写出F→G的化学方程式: 。
26.(A)某学生实验兴趣小组拟用图1装置来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验。
(1)各仪器接口连接顺序是 (用接口字母填写)。
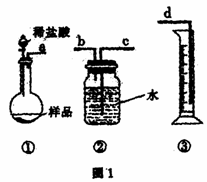 (2)该装置连接好未装药品前,检验气密性的操作是
(2)该装置连接好未装药品前,检验气密性的操作是
。
(3)甲同学认为上述方法误差较大,提出如下改进
措施,你认为可行的有 (填序号)。
A.将装置①中稀盐酸换成稀硫酸,装置②中
水面上滴加少量植物油
B.将装置①中稀盐酸换成稀硫酸,装置②中
水换成饱和NaHCO3溶液
C.将装置①中稀盐酸换成稀硫酸,装置②中
水换成饱和Na2CO3溶液
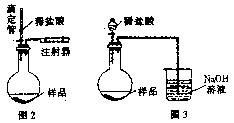 (4)乙同学认为在装置②③之间的导管内会
(4)乙同学认为在装置②③之间的导管内会
积存水,使测定结果不准,从而改用图
2装置。假定滴定管起始读数为V1mL,
终了读数为V2mL,而注射器测定排出
的气体为V3mL(标准状况下),
混合物样品质量为m g,则原混合物中
NaHCO3的质量分数的表达式为
(用含V1、V2、V3、m的式子表示)。
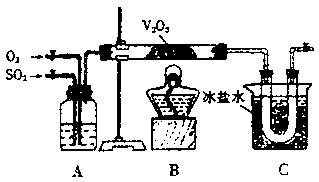 26.(B)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如右图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。
26.(B)某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如右图所示的装置。已知三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。
试回答:
(1)A装置可用来观察二氧化硫和氧气的进气量。实验时应使A中两根导气管冒出气泡的速率相等,其目的是 ,
A中的药品是 。
(2)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是
。
(3)在实验过程中不能持续加热的理由是 。
(4)C装置用来收集三氧化硫,其中冰盐水的作用是 ;若用ag铜跟足量浓硫酸反应制二氧化硫,实验结束时得到bg三氧化硫,则该实验中二氧化硫的转化率不小于 。
(5)为了减轻实验对环境的污染,请你设计尾气处理装置(用简要文字说明):
。
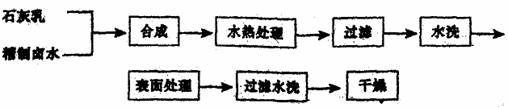 27.往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃剂Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
27.往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃剂Mg(OH)2,树脂可燃性大大降低。该Mg(OH)2的生产工艺如下:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-nCln·mH2O],反应的化学方程式为 。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:
Mg(OH)2-nCl·mH2O→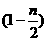 Mg(OH)2+
Mg(OH)2+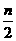 MgCl2+mH2O
MgCl2+mH2O
水热处理后,过滤、水洗。
①检验滤液中含有Cl-的方法是 。
②水洗的目的是 。
(3)阻燃剂Mg(OH)2具有晶粒大、易分散、与高分子材料相溶性好等特点。上述工艺流程中与此有关的步骤是 。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJ
Al(OH)2(s)→ Al2O3(s)+
Al2O3(s)+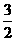 H2O(g)-87.7kJ
H2O(g)-87.7kJ
①Mg(OH)2和Al(OH)2都能起阻燃作用,其主要原因是 。
②等质量Mg(OH)2和Al(OH)2相比,阻燃效果较好的是 ,
原因是 。
(5)常用阻燃剂主要有三类:卤系,如四溴乙烷;磷系,如磷酸三苯酯;无机类,主要是Mg(OH)2和Al(OH)2。从环保的角度考虑,应用时较理想的阻燃剂是 类,
原因是 。
25.氮气和氢气在一定条件下在一密闭容器中发生如下反应:
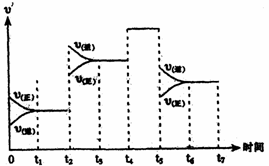
 N2(g)+3H2(g) 2NH3(g)+Q
(Q>0)。
N2(g)+3H2(g) 2NH3(g)+Q
(Q>0)。
(1)写出该反应的化学平衡常数表达式
。
(2)降低温度,该反应的K值 ,
化学反应速率 ,氨气的百
分含量 (以上均填“增大”、
“减小”或“不变”)。
(3)上图表示上述反应在某一时间段中反应
速率与反应过程的关系图。据图判断氨
的百分含量最高的一段时间是 。
(4)据图判断反应在t2~t3这段时间内,曲线变化的原因是 (用文字表达),
t5~t6时间内曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.扩大容器的体积 c.降低温度 d.增加了NH3的量
(5)丙同学改用图3装置,通过测定烧杯中NaOH溶液的增重来确定样品中NaHCO3的含量。你认为乙、丙两同学的方案中更合理的是 ,理由是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com