
题目列表(包括答案和解析)
6.设阿伏加德罗常数约为6.02 x1023mol一1,下列叙述中正确的是
A.常温下,4.4gCO2和N2O混合物中所含有的原子数约为0.3x6.02xl023
B.足量的锌与一定量的浓硫酸充分反应,放出 2.24L气体时,转移电子数约为
5.大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定是没有意义的是
A.探究S02和Na202反应可能有Na2S04生成 B.探究Na与水的反应可能有02生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的Na0H溶液中通以 Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
4.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
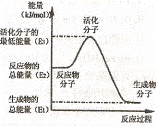
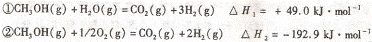
下列说法正确的是
A.根据②推知:在25℃,101kPa时,lmolCH3OH (g)燃烧生成
CO2 和HZO(I)放出的热量应大于192.9kJ
B.反应②中的能量变化如右图所示,则△H2=E1一E3
C.H2燃烧能放出大量的热,故CH30H转变成H2的过程必须吸收能量
D.CH30H的燃烧热 △H=一192.9kJ·mol一1
3.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是 ①用50m1量筒取5.2mL稀硫酸; ②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量11.7g氯化钠晶体;④用碱式滴定管取23.10mL溴水; ⑤用瓷坩埚灼烧各种钠的化合物;⑥用250mL容量瓶配制250mL 0.2mol/L的NaOH溶液。
A.①②④ B.②③④⑥ C.③⑥ D.③⑤⑥
2.下列化学用语错误的是
A.氨分子的结构式: 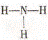 B.二氧化碳的电子式:
B.二氧化碳的电子式: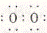
C. Mg2+结构示意图: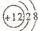 D.乙烯的最简式: CH2
D.乙烯的最简式: CH2
1.2007年12月22日,沉睡在海底800余年的南宋时古沉船“南海一号”被成功打捞,谱写了我国考古工作的新篇章。下列叙述中不正确的是
A.出水的大量瓷器为传统的硅酸盐产品
B.古船保存得较为完好的原因之一是沉没后很快为淤泥所覆盖
C.随船沉浸在海水中的铜、银等古钱币和铁制品,以铁制品被腐蚀的最厉害
D.据推测,为“南海一号”提供动力的物质是“可燃冰”
21、(8分)铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
|
剩余金属/g |
30.4 |
22 |
12.8 |
|
NO体积/mL |
2240 |
4480 |
6720 |
由上述数据推测:
(1)硝酸的物质的量浓度。
(2)③比②多溶解部分的金属,其成分是什么?其相应的质量又为多少克?
(3)向反应后的①中加入足量的该稀硝酸时,又生成气体的体积在标准状况下为多少L?
、
20、下图中A、B、C、D、E、F、G均为有机化合物。注:A的分子式应为C13H1803
⑴ D的化学名称是 。
⑵ 反应③的化学方程式是 。
⑶ B的分子式是 ,
A的结构简式是 。反应①的反应类型是 。
⑷ 符合下列三个条件的B的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与B具有相同的官能团;③不可与FeCl3溶液发生显色反应写出其中任意一个同分异构体的结构简式 。
⑸ G是重要的工业原料,用化学方程式表示G的一种重要工业用途
。
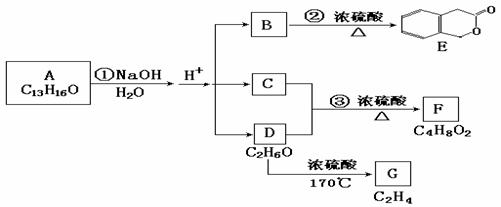
19、 (10分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(10分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)。
18、(10分)A、B、C、D为周期表中前三周期元素,A元素原子的次外层电子数是最外层电子数的二分之一,B的阴离子核外只有一个电子层、C单质在标准状况下密度是1.43g/L,D元素的焰色反应呈黄色。将以上四种元素组成的结晶盐3.4g加热反应至完全失去结晶水,其质量减少1.35g,所得无水盐中C元素的质量分数为39%,将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2,已知这种弱酸的一个分子中共有32个质子。试回答:
(1)A、B、C、D四种元素各是什么元素:A B C D
(填元素符号)
(2)求结晶盐化学式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com