
题目列表(包括答案和解析)
22.(8分)用化学方法测定微量碘化物时,必须利用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是“化学放大”反应的实验步骤:
①向含微量I-并且呈中性或弱酸性溶液里加入溴水,将I-完全氧化成IO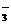 ,煮沸去掉过量的Br2;
,煮沸去掉过量的Br2;
②向由①制得的水溶液中加入过量的酸性KI溶液,振荡使反应进行完全;
③在②得到的水溶液中加入足量的CCl4,振荡,把生成的I2从水溶液里全部转移到CCl4中,用分液漏斗分液去掉水层;
④将③得到的CCl4层加入肼(即联氨H2N-NH2)的水溶液,振荡,使I2完全以I-形式从CCl4层进入水层,用分液漏斗分液去掉CCl4层。
经过以上四步得到的水溶液里,含有通过反应而“放大”了的碘,请回答下列问题:
 (1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目:
(1)写出步骤②的离子方程式,并标出下列反应的电子转移的方向和数目:
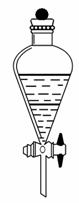
(2)将右图所示的分液漏斗中下层液体放出的操作步骤为:
① 。
②旋开活塞,使下层液体流出到一个烧杯里,当下层液体全部流出活塞的细孔时, 。
③从漏斗上口倒出上层液体。
④旋开活塞,将留在颈部的下层液体放出到盛接下层液体的烧杯里。
(3)若忽略实验过程中出现的损失,经过一次“化学放大”的溶液里,I-的量是原溶液里I-的量的 倍。经过n次“化学放大”的溶液里,I-的量是原溶液里的量的 倍。
21.(9分)茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素。
[查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;Ca、A1、Fe完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3;pH≥5.5;Fe(OH)3:pH≥4.1)
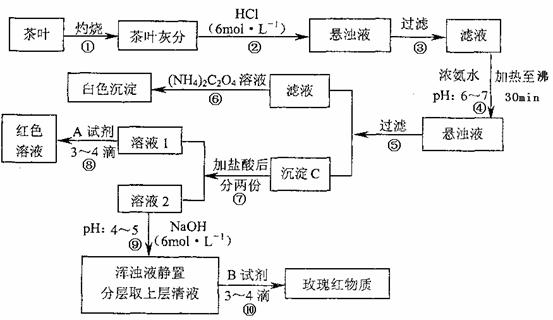
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30min的作用是 。
(2)写出检验Ca2+的离子方程式 。
(3)写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,猜测步骤⑩的目的是 。
20.(11分)铁合金是金属材料王国的霸主,亚铁盐、铁盐等铁的重要化合物也在不同领域中扮演着重要的角色。这些化合物之间可以相互转化,利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
 0
+2
+3
0
+2
+3
Fe Fe Fe
(1)写出实现上述各步转化的化学方程式(是离子反应的,只写离子方程式):
① ; ② ;
③ ; ④ 。
(2)FeCl3可用作印刷电路铜板腐蚀剂。用FeCl3溶液腐蚀印刷电路铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
19.(10分)氧族元素的各种性质可归纳整理出如下(部分):
|
元素 性质 |
8O |
16S |
Se |
52Te |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径(nm) |
0.074 |
0.102 |
0.116 |
0.143 |
|
单质与H2反应 |
点热易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
回答下列问题:
|
(2)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:
。
 (3)碲的主要化合价可能有
。
(3)碲的主要化合价可能有
。
(4)工业上可用Al2Te3制备H2Te,化学方程式为:
。
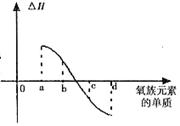
(5)右图所示为上述氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应)。则:b代表 ,d代表 (写化学式)。
(四)请你参与以下探究
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加以验证。
|
猜想 |
验证方法 |
预测现象及结论 |
|
认为铜片中可能含有锌等杂质 |
|
|
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案。
|
猜想 |
预设验证方法 |
猜想的现象与结论 |
|
白色沉淀 是氯化亚铜 |
|
|
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并指出生成沉淀的原因,实际上是[CuCl4]3-等离子与CuCl(s)、Cl-三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示) 。
(三)背景资料
|
资料卡片 主题:生成一价铜的反应 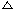 ① 必修一,P116:4CuO === 2Cu2O + O2↑ ① 必修一,P116:4CuO === 2Cu2O + O2↑②《无机化学》下册,p705:2Cu2+ + 4I- == 2CuI(白色)↓+ I2 ③《无机化学》下册,p706:氯化亚铜(CuCl)在不同浓度的KCl溶液中可形成[CuCl4]3+等无色离子。 |
(二) 实验记录:
|
交流卡片 主题:Zn、Cu与浓盐酸间的实验 A.将锌放入浓盐酸的实验 B.将锌与铜片贴在一起,一同放入浓盐酸中,反应快速放出气体 C.当实验B中锌片完全溶解后,将溶液加热,又产生大量气体,得到无色溶液 D.将实验C反应后的溶液隔绝空气,加入适量水,出现白色沉淀 |
(一) 实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液
17.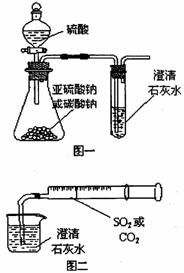 (8分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。回答下列问题:
(8分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓缓地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象。回答下列问题:
(1)写出实验中制取SO2的化学反应方程式:
。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是
。
(3)用图一进行SO2与石灰水反应的实验时,从安全或环境角度考虑,该装置可如何改进?
。
(4)区别SO2和CO2气体可选用的试剂是 。
A.石蕊试液 B.KMnO4溶液
C.品红溶液 D.酸化的Ba(NO3)2溶液
18.(10分)某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
16.把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是( )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的 物质的量之比 |
8﹕1 |
9﹕2 |
1﹕8 |
2﹕9 |
|
原稀盐酸的 物质的量浓度(mol/L) |
3.4 |
1.1 |
1.8 |
1.3 |
第Ⅱ卷(非选择题,共64分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com