
题目列表(包括答案和解析)
19(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体___________________________________
(2)如何保证在70℃-80℃条件下进行滴定操作:_______________________________
(3)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O
①滴定终点标志是_________ _________;
②KMnO4溶液的物质的量浓度为________________mol/L;
③若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或“偏低”)
20.(8分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
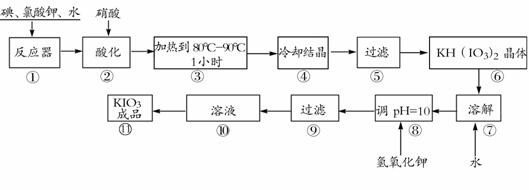
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
18.(8分)(1)多硫离子Sx2-(x是2-6整数)碱性溶液中被BrO3-氧化成SO42-,BrO3-自身被还原成Br-,该反应的离子方程式是
3Sx2-+6(x-1)OH-+(3x+1)BrO3- 3xSO42-+(3x+1)Br-+3(x-1)H2O
该反应中Sx2-作还原剂。每1mol Sx2-失去 mol电子。若通过测定BrO3-与OH-的用量情况来确定x的值,至少需要确定以下A-C中的 才能确定Sx2-中的x的值.
A.BrO3-或OH-的绝对用量 B.BrO3-与OH-的绝对用量
|
 (2)多硫化钠是一种重要的多硫化物,利用反应2Na+xS
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的
极相连接。
(2)多硫化钠是一种重要的多硫化物,利用反应2Na+xS
Na2Sx在一定条件下制成的钠硫可逆电池是目前推广使用的一种新型高能电池,该电池工作时的正极反应是
,给该电池充电时,钠极反应与外电源的
极相连接。
17.(6分)C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)按要求指出下列物质的成键方式、原子的杂化方式。
①C2H2分子碳碳之间的成键方式 ,C原子的杂化方式 。
②SiO2硅氧之间的成键方式 ,Si原子的杂化方式 。
(3)CO可以和很多金属形成配合物,如Ni (CO)4,Ni与CO之间的键型为
16.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.52倍,
则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.温度不变时,若压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的1/2要小
第Ⅱ卷 非选择题(共64分)
15. 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关该化合物的叙述正确的是( )
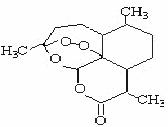
A.分子式为:C16H20O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.青蒿素与维生素一样是水溶性的
D.该化合物中含有过氧键,一定条件下有氧化性
14. 0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是( )
A [SO42-] > [HS-] > [OH-] > [H+]
B [Na+] > [K+] > [H+] > [OH-]
C [Na+]=[S2-]+[H2S]+[HS-]+[SO42-]
D [Na+]+[K+]+[H+]=[SO42-]+[S2-]+[HS-]+[OH-]
13.下列离子方程式不正确的是
A.三氯化铝溶液中加入过量氨水:Al3++3OH―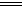 Al(OH)3↓
Al(OH)3↓
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:
4AlO2―+7H++H2O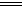 3Al(OH)3↓+Al3+
3Al(OH)3↓+Al3+
C.在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+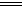 5Pb2++2MnO4-+2H2O
5Pb2++2MnO4-+2H2O
D.将0.1mol/L盐酸数滴缓缓滴入0.1mol/L25mLNa2CO3溶液中,并不断搅拌:
2H++CO32-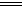 CO2↑+H2O
CO2↑+H2O
12.已知HBrO比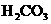 酸性弱,
酸性弱,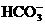 比HBrO难电离,则下列反应不能发生的是( )
比HBrO难电离,则下列反应不能发生的是( )
A.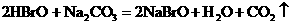
B.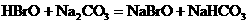
C.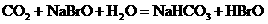
D.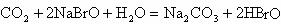
11. 下列关于浓硝酸和浓硫酸的叙述正确的是( )。
A.都是常用的干燥剂
B.分别露置在空气中,容器内溶质的物质的量浓度都降低
C.都可以储存于铝制槽罐中
D.和铜反应中都只表现出强氧化性
10.钡在氧气中燃烧时的得到一种钡的氧化物晶体,结构如下图所示,有关说法正确的是
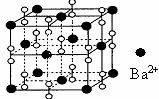 A.该晶体属于离子晶体
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有6个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com