
题目列表(包括答案和解析)
0.010 mol/L× 5.00×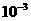 L
n(HCl)
L
n(HCl)
得:n(HCl)=0.010 mol/L×5.00×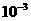 =
=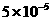 mo1
mo1
则与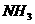 反应的盐酸中HCl物质的量为:
反应的盐酸中HCl物质的量为: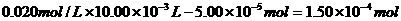 。依题意有如下关系:
。依题意有如下关系:
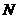 -
- 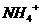 -
-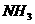 -HCl
-HCl
1 mo1 1 mo1
n(N) 1.50×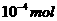
得:n(N)=1.50×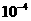 mol则1 mL蛋白质溶液中含蛋白质的质量为:
mol则1 mL蛋白质溶液中含蛋白质的质量为:
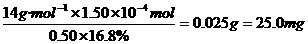
答案 25.0 mg
点拨 本题在了解蛋白质组成的基础上,运用题目所给信息,找出实验过程中氮元素的转化途径,利用关系式进行化学计算。解题过程中应注意规范化和有效数字的运算。
[思维障碍点拨]
例3 可以判断油脂皂化反应基本完成的现象是 ( )
A.反应液使红色石蕊试纸变成蓝色
B.反应液使蓝色石蕊试纸变成红色
C.反应后,静置,反应液分为两层
D.反应后,静置,反应液不分层
解析 油脂皂化反应前后溶液均呈碱性,故不可用A判断,B为错误叙述。反应前油脂不溶于水而分层,完全反应后其产物高级脂肪酸钠和甘油都溶于水,反应液中没有油脂而不再分层。
答案 D
点拨 本题易错选A,思维障碍的原因是不了解高级脂肪酸的酸性强弱,不能应用盐类的水解来判断溶液的酸碱性。高级脂肪酸的酸性很弱(一元脂肪酸的酸性随烃基的增大而减弱),其钠盐在水溶液中因水解而呈较强的碱性。解决的方法是加深对各类物质性质的理解,并提高综合应用的能力。
[灵活应用点拨]
例4 人们每天都要摄取大量的淀粉类物质,以维持机体的营养均衡。这是因为淀粉在唾液淀粉酶的作用下或在酸性环境下可以水解成葡萄糖;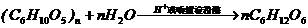 。经验证明,人在长期饥饿或肝功能减退的情况下,会出现头晕、心慌、出冷汗等症状。而当一个人多食少动使得摄入的糖类过多时,又会导致肥胖。试由此推导葡萄糖在人体内的变化。
。经验证明,人在长期饥饿或肝功能减退的情况下,会出现头晕、心慌、出冷汗等症状。而当一个人多食少动使得摄入的糖类过多时,又会导致肥胖。试由此推导葡萄糖在人体内的变化。
解析 人在长期饥饿的情况下,会出现头晕、心慌等症状,说明身体缺乏能量,因而可推知葡萄糖可以氧化分解,放出能量。人在肝功能减退的情况下,也会出现上述症状,可推知葡萄糖可以合成肝糖元。而人在多食少动的情况下会发胖,说明葡萄糖也可以转变成脂肪。
答案 葡萄糖在人体内有三种变化:(1)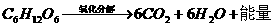 ;
;
(2)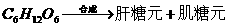 ;(3)
;(3) 。
。
点拨 本题是生物、化学知识的综合应用,根据题目中所给出的信息,结合学过的生物知识和化学知识,进行分析推理。将课本知识与生活实践相结合,提高综合思维能力和灵活应用的能力。
例5 根据下列的条件,完成后面的问题。
在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
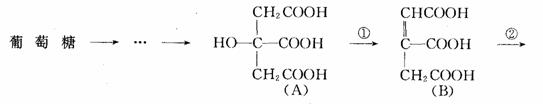
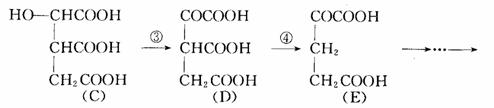
请填空:(1)过程①是__________反应,过程②____________反应,过程③_______
(填写反应类型的名称)。
(2)过程④的另一种生成物是_______________(填写化学式)。
(3)上述物质中_________和 ____________互为同分异构体(填写字母代号)。
解析 (1)由(A)物质转化为(B)物质就是醇羟基脱去一分子水形成碳碳双键,因而是消去反应;由(B)物质转化为(C)物质实质就是碳碳双键断裂,两个不饱和碳原子分别结合一个氢原子和一个羟基,所以是加成反应;由(C)物质转化为(D)物质,分子中脱去了两个氢原子,由-OH变成了C=O双键,故属于氧化反应。
(2)比较(D)和(E)的分子结构可发现,(D)的中间的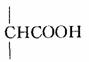 变成了(E)中的
变成了(E)中的 ,少了一个碳原子和两个氧原子,可能生成
,少了一个碳原子和两个氧原子,可能生成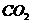 。
。
(3)从官能团的种类和数量上看:(A)和(C)完全相同,但-OH的位置不同,检查(A)和(C)的分子式,发现分子式相同,因此(A)和(C)互为同分异构体;而其它物质间不可能互为同分异构体。
答案 (1)消去;加成;氧化(2)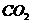 (3)A、C
(3)A、C
点拨 葡萄糖属于多羟基醛,因而既具有醇的性质(如消去反应、氧化反应、酯化反应等),又具有醛的性质(如氧化反应、还原反应等)。本题可根据官能团的变化来判断反应的类型,根据官能团的种类和数目及各物质的组成来判断及同分异构体。
[研究性学习方法]
例6 根据下列实验,完成后面的问题。
为验证pH值对唾液淀粉酶活性的影响,实验如下:
(1)操作步骤:
①在l-5号试管中分别加入0.5%淀粉溶液2mL。②加完淀粉溶液后,向各试管中加入相应的缓冲液3 mL,使各试管中反应液的pH依次稳定在5.00、6.20、6.80、7.40、8.00。③分别向1-5号试管中加入0.5%唾液1 mL,然后进行37℃恒温水浴。④反应过程中,每隔1 min从1-5号试管中各取一滴反应液,滴在比色板上,加1滴碘液显色,待其中有呈橙黄色时,立即取出5支试管,加碘液显色并比色,记录结果。
(2)结果见下表(“十”表示蓝色的深浅程度)
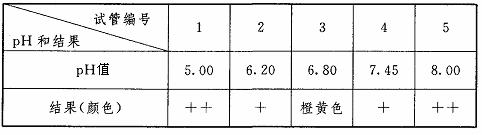
请回答:(1)实验过程中为什么要选择37℃恒温?
(2)3号试管加碘液后出现橙黄色,说明什么?
(3)如果反应速率过大,应当对唾液作什么样的调整?
(4)该实验得出的结论是什么?
解析 (1)因为温度对化学反应的速率及酶的活性等都有很大的影响,要验证pH对唾液淀粉酶活性的影响,只有在恒温的条件下,才能排除温度因素对实验结果的干扰。
(2)碘液本身呈橙黄色,3号试管没有变蓝色,说明3号试管里的反应液中没有淀粉存在,淀粉已经完全水解。
(3)如果反应速率过大,不利于对现象的观察对比,可以提高唾液的稀释倍数,减小反应液中淀粉酶的浓度。
(4)从实验结果来看,第3号试管里的淀粉最先水解完全,说明反应速率最大,即唾液淀粉酶的最适宜pH值是6.8,高于或低于此pH时,酶的活性逐渐降低。
答案 略
点拨 这是一个研究pH值对唾液淀粉酶活性的影响的实验,关键是控制实验的变数。研究某一因素的变化产生影响时,尽可能地使其它影响因素相同,以排除其它因素的干扰。本题有利于提高实验设计能力和观察分析能力。请设计研究温度对唾液淀粉酶活性的影响的实验。
[课本复习题解惑]
有机物的分离方法应具体问题具体分析,有的根据沸点不同进行蒸馏或分馏,有的根据溶解性不同进行萃取分液或采用结晶过滤的方法,有的采用水洗、酸洗或碱洗的方法而提纯。
(1)加NaOH溶液,分液,如苯(苯甲酸)、苯(苯酚)、溴苯(溴)、硝基苯(混酸)等;加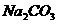 饱和溶液,分液,如乙酸乙酯(乙酸)。(括号内物质为杂质)
饱和溶液,分液,如乙酸乙酯(乙酸)。(括号内物质为杂质)
(2)加CaO,蒸馏;如乙醇(水);加NaOH,蒸馏,如乙醛(乙酸)。
(3)加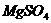 ,过滤,如乙酸乙酯(水);加
,过滤,如乙酸乙酯(水);加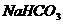 ,溶液,过滤,如苯酚(苯甲酸)。
,溶液,过滤,如苯酚(苯甲酸)。
(4)加NaC1,盐析,如高级脂肪酸钠(甘油):通过溴水,洗气,如乙烷(乙烯)。
[综合思维点拨]
例1 已知生成1
mol葡萄糖需要吸收2804KJ热量,太阳每分钟对地球表面辐射能量量为2.1J/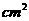 ;设光合作用时太阳能的利用率为10%,每片树叶按
;设光合作用时太阳能的利用率为10%,每片树叶按 估算,这样的树叶1000片要合成18g的葡萄糖,需光照多长时间?若空气中
估算,这样的树叶1000片要合成18g的葡萄糖,需光照多长时间?若空气中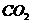 的体积百分含量为0.3%,需要标准状况下的空气多少升?同时放出标准状况下的
的体积百分含量为0.3%,需要标准状况下的空气多少升?同时放出标准状况下的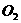 多少升?
多少升?
解析 本题依据高中生物(试验修订本·必修)第一册第三章中光合作用的反应式;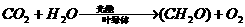 ,结合葡萄糖的分子式
,结合葡萄糖的分子式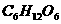 ,可得出树叶进行光合作用生成葡萄糖的化学反应方程式,再利用光合作用需要吸收的能量进行计算。
,可得出树叶进行光合作用生成葡萄糖的化学反应方程式,再利用光合作用需要吸收的能量进行计算。
设合成18
g葡萄糖需要光照时间为x分钟,则: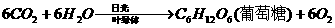
180g 吸收的能量
18g 2804KJ
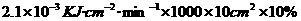
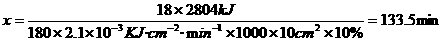
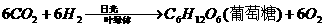
6×22.4L 180g 6×22.4L
0.3%V(空气)
18g
V(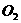 )
)
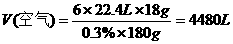
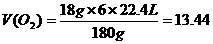
答案 133.5 min,4480L;13.44 L。
点拨 本题是将生物、化学知识综合运用,结合题目所给出的信息,对信息进行加工、处理、并运用于问题的解答中。在解答过程中,注意对数据的分析处理,单位的正确选用,否则计算结果将不正确。
例2 某蛋白质含氮的质量分数为16.8%,现欲测定每毫升该蛋白质溶液中含蛋白质的质量,做了如下实验:取该蛋白质0.50mL,用含催化剂的热硫酸处理,使蛋白质中的有机氮全部转变为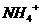 ,然后用强碱溶液处理,并用10.00mL0.020mol/L的盐酸吸收逸出的全部氨气,再用0.010mol/L的NaOH溶液中的未反应的盐酸,消耗NaOH溶液5.00mL。求每毫升该蛋白质溶液中含多少毫克蛋白质?
,然后用强碱溶液处理,并用10.00mL0.020mol/L的盐酸吸收逸出的全部氨气,再用0.010mol/L的NaOH溶液中的未反应的盐酸,消耗NaOH溶液5.00mL。求每毫升该蛋白质溶液中含多少毫克蛋白质?
解析 实验过程中存在多步化学反应,有的反应虽然不能书写出化学方程式,但都有关系判断,都有确定的数量关系,所以可依据这些反应建立关系式,找出有机氮与所消耗盐酸之间确定的数量关系则可解出。
NaOH
+ HCl = NaCl+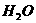
l mol 1 mo1
(1)根据有机物的溶解性:通常是加入水振荡,观察其是否能溶于水。例如,用此法可鉴别乙酸(乙醇)与乙酸乙酯、乙醇与氯乙烷、甘油与油脂、硝基苯与混酸(浓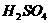 和
和 的混合物)等。
的混合物)等。
(2)依据不溶于水的有机物的密度:观察不溶于水的有机物在水中的分层情况,水在上层还是在下层。例如,用此法可鉴别硝基苯与苯、四氯化碳与汽油、乙酸乙酯与溴苯等。
(3)依据有机物的燃烧情况:观察是否可燃(大部分有机物可燃,四氯化碳等与多数无机物不可燃);燃烧时黑烟的多少和火焰的明亮程度(可区分乙烷、乙烯和乙炔,己烷和苯,聚乙烯和聚苯乙烯等);燃烧时的气味(可鉴别聚乙烯、聚氯乙烯、蛋白质等)。
(4)依据有机物官能团的特性。思维方式为:官能团→性质→方法的选择。常见的试剂与方法见下表。
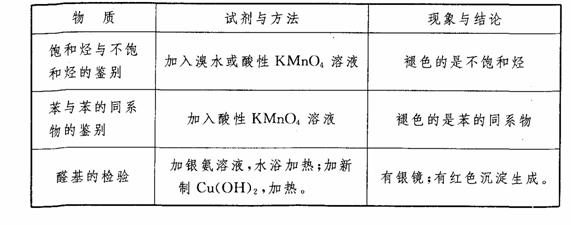
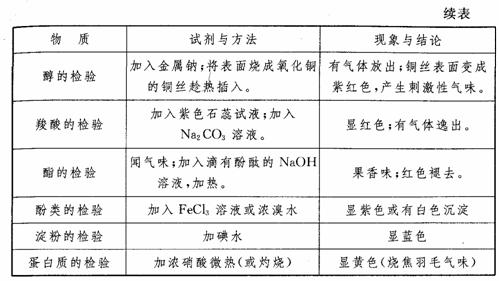
银镜反应是检验有机物分子中是否存在醛基的反应。在中学化学中含有醛基的有机物有:
(1)醛:如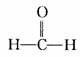 、
、 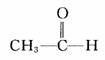 、
、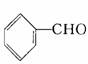 等。
等。
(2)甲酸和甲酸的酯:如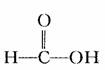 、
、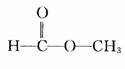 等。
等。
(3)部分糖:如葡萄糖、麦芽糖等。
淀粉在酸的作用下能够发生水解反应最终生成葡萄糖。反应物淀粉遇碘能变蓝色,不能发生银镜反应;产物葡萄糖遇碘不能变蓝色,能发生银镜反应。依据这一性质可以判断淀粉在水溶液中是否已发生了水解和水解是否已进行完全。如果淀粉还没有水解,其溶液中没有葡萄糖,则不能发生银镜反应,如果淀粉已完全水解,其溶液中没有淀粉,遇碘则不能变蓝色;如果淀粉仅部分水解,其溶液中有淀粉,还有葡萄糖,则既能发生银镜反应,又能遇碘变成蓝色。
实验室中蔗糖、淀粉、纤维素等常在无机酸(如稀硫酸)催化作用下发生水解,有葡萄糖生成,欲检验水解产物葡萄糖的生成,必须先加入NaOH溶液中和作催化剂的硫酸,再加入银氨溶液或新制氢氧化铜悬浊液进行检验,因为这两个反应都是在碱性条件下才能发生的。
24.(8分)氨气极易溶于水,人们把氨气溶于水后得到的 溶液称为氨水。
(1)将标准状况下11.2 L氨气溶于100 mL水中,得到密度为0.868 g/cm3的氨水。求所得氨水的物质的量浓度。
(2)将上述30 mL氨水与70 ml 2 mol/L的A1C13溶液混合,生成的沉淀质量为n g,求n值。
(3)若往上述(2)反应后未过滤的浊液中加入y mL 5 mol/L的NaOH溶液后,仍得到沉淀物质量为n g,求所加氢氧化钠溶液的最大体积。
23.(6分)下图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,试回答:(1)浓度为9.75mol/L的HNO3溶液与少量金属铁反应时,得到混合气体的成分是 ,它们的体积比为 。
(2)将14.56g铁粉投入大量的9.75mol/LHNO3溶液中(因硝酸溶液大量,故其浓度维持不变),当铁粉完全溶解后收集到气体6.048L(标准状况),求反应中消耗HNO3的总物质的量。
22.(10分)下面是有名的Diels-Alder反应的一个实例:
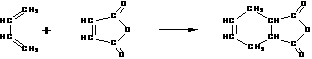
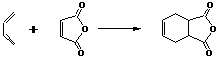 也可用下面相应的键线式表示:
也可用下面相应的键线式表示:
请认真分析上述变化,回答下列问题:
以某链烃A为起始原料合成化合物G的路径如下(图中Mr表示相对分子质量):
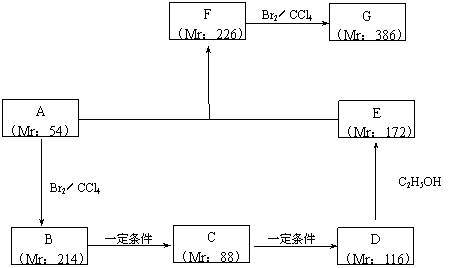
(1)指出反应类型:B→C : ,F→G : 。
(2)写出下列物质的结构简式:
A : ,F : 。
(3)写出下列反应的化学方程式:
B → C : ;
D → E : 。
21.(8分)A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有转化关系:
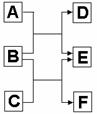 (1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气。B、D、F皆为非金属单质,且D为气体。则A的结构式为
, 1molC中含有
个共价键。
(1)若A、C、E皆为氧化物,且常温下A为无色液体,E为有毒气。B、D、F皆为非金属单质,且D为气体。则A的结构式为
, 1molC中含有
个共价键。
(2)若A、C、E皆为氢化物,三者皆为极性分子,其中C的相对分子质量最小;D、E、F皆为氧化物, 其中D、F为有毒气体。则
①A、C、E沸点由高到低的顺序为 (填化学式)。
②A跟D常温下反应可生成一种单质,化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com