
题目列表(包括答案和解析)
8.规格为A mL的滴定管,其尖嘴部分充满液体时,液面在m mL处,当其液面降至n mL处时,下列说法正确的是 ( )
A.流出的液体为(m-n)mL B.流出的液体为(n-m)mL
C.管内剩余液体为(A-n)mL D.管内剩余液体为n mL
7.下列物质能通过化合反应直接制得的是 ①FeCl2 ②H2SO4 ③NH4NO3 ④HCl ( )
A.只有①②③ B.只有②③ C.只有①③④ D.全部
6.下列溶液一定呈中性的是 ( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
5. 对于达到平衡状态的可逆反应:N2+3H2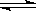 2NH3(正反应为放热反应)下列叙述正确的是 ( )
2NH3(正反应为放热反应)下列叙述正确的是 ( )
A.反应物和生成物的浓度相等
B.N2和H2的浓度之比一定为1∶3
C.降低温度,平衡混合物里NH3的浓度增大
D.增大压强,不利于氨的合成
4.下列说法正确的是 ( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
D.硫酸厂厂址的选择应靠近原料产地
3.下列反应中,调节反应物用量或浓度,不会改变反应产物的是 ( )
A.硫化氢在氧气中燃烧 B.铜在硫蒸气中燃烧
C.二氧化硫通入石灰水中 D.硫酸中加Zn粒
2.下列说法正确的是
A.6.2g氧化钠和7.8g过氧化钠混合物中所含有的离子数目约为0.7×6.02×1023
B.1L 0.1mol•L-1Na2CO3溶液中, CO32-的数目小于0.1×6.02×1023
C.6.4 gSO2在一定条件下与足量氧气充分反应后失去的电子数目约为0.2×6.02×1023
D.标准状况下,22.4L CH4和CHCl3的混合物所含有的分子数目约为6.02×1023
1. 1995年我国科学家发现了91号元素的一种新原子,其质量数为239,则该原子的中子数与质子数的差值是 ( )
A. 91 B.239 C.148 D. 57
22. (10分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(10分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式:
;
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数为 。
姓名 考号 班级
湖北黄石二中高三年级八月月考
21.(16分)工业接触法制硫酸的流程如下图所示:
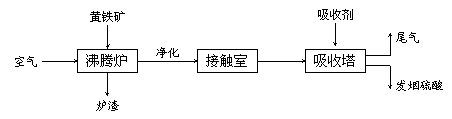

(1)写出沸腾炉中发生反应的化学方程式: 。
(2)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成是:SO2 7 %,O2 11 %,N2 82 %。从接触室出来的气体中SO3的体积分数为7 %,则SO2的转化率为 。
(3)接触室采用常压而不采用高压的原因是__ 。
(4)在吸收塔中为什么用98.3 %的浓硫酸而不是用水吸收SO3?
每100 g SO3气体与H2O完全反应放出热量162.9 kJ,该反应的热化学方程式为 。
(5) 某硫酸厂每天用含FeS2 60%的硫铁矿500 t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%。每天能生产98%的硫酸___ ______吨。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com