
题目列表(包括答案和解析)
29.(18分)某有机物A(只含C、H、O)是一种重要化工生产的中间体,其蒸气密度是相同状况下氢气密度的83倍。试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A可与NaHCO3溶液作用,产生无色气泡;
③A在一定条件下可与乙酸发生酯化反应。
请写出:
(1)A的分子式 ;A的一种可能的结构简式 ;
A中含氧官能团的名称 。
若有机物A存在如下转化关系(见下框图),请据此时A的结构回答(2)、(3)、(4)问:

(2)请写出: A→C和B→D的化学反应方程式(注明反应条件),并注明反应类型:
A→C: ,反应类型: ;
B→D: ,反应类型: 。
(3)A的一种同分异构体F,其苯环上有两个相邻的取代基,且能与三氯化铁溶液发生显色反应。F在稀硫酸存在下水解生成G和H,其中H俗称“木精”,是饮用假酒过程中致人失明、甚至死亡的元凶。
请写出F的结构简式: 。
(4)已知H在一定条件下可被氧化成K,K的水溶液常用作防腐剂,请写出:H→K的化学方程式: 。
28.( 10分)
甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
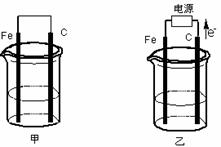
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
27.(10分)如图所示,A-J分别表示中学化学中常见的一种物质,它们之间的相互关系如下:A为坚硬难熔的主族元素的氧化物,B为黑色晶体
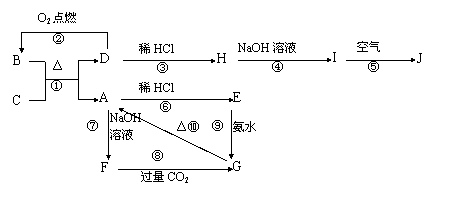
则(1)写出物质的化学式
B F
(2)写出反应①、⑤的化学方程式
① ⑤
(3)写出反应⑧的离子方程式
26.(14分) U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,其在W2中燃烧可生成淡黄色固体。Z的单质在W2中燃烧的产物可使品红溶液褪色。Y的单质也是一种金属,该金属在UW2中剧烈燃烧能生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_________;Y W的电子式为_____ ____;
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
(3)U、V、W分别与氢元素可形成10电子氢化物。U、V的氢化物中沸点较低的是(写化学式)__ ;V、W的氢化物分子中结合H+能力较强的是(写化学式)___ ___,请用一个离子方程式加以证明_____ ____________。
(4)已知通常状况下1g Z在W2中完全燃烧放出a kJ的热量,请写出表示Z燃烧热的热化学方程式 。
25.下列有关实验的叙述中,不正确的有 ( )
①乙酸乙酯中混有乙酸,可选用饱和 Na2CO3溶液洗涤,然后将两层液体分开;
②试管里加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;
③仅用蒸馏水就可鉴别蔗糖、硫酸铜粉末、碳酸钙粉末;
④溴乙烷与NaOH的乙醇溶液混合共热可得到乙烯;
⑤滴定时左手控制滴定管,右手握持锥形瓶,边滴边摇动锥形瓶,眼睛注视滴定管中的液面;
⑥用盐析法分离高级脂肪酸钠和甘油的混合溶液;
⑦用渗析法除去蛋白质胶体中混有的少量Na+和Cl-。
|
第Ⅱ卷(非选择题,共60分)
24.右图中,两电极上发生的电极反应为:
a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+
下列说法中不正确的是 ( )
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
23.下列溶液中各微粒的浓度关系正确的是 ( )
A.0.1 mol•L-1 NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+)>c(OH-)
B.0.1 mol•L-1 Na2S溶液中:2c(Na+) = c(S 2-) + c(HS-) + c(H2S)
C.0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:
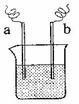 c(Na+) = c(CH3COO-) >c(H+) = c(OH-)
c(Na+) = c(CH3COO-) >c(H+) = c(OH-)
22.将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)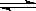 2C(g);△H <0 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1
,下列说法中正确的是 ( )
2C(g);△H <0 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1
,下列说法中正确的是 ( )
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol·L-1·S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将减小
21.珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是( )
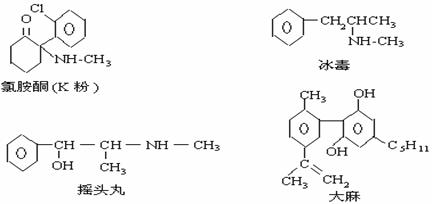
A.K粉的分子式为C13H16ClNO
|
C.1mol大麻最多可与含4mol Br2 的浓溴水发生反应
D.摇头丸不可能发生加成反应
20.充分利用能源、提高原子利用率、减少向环境排放废弃物等都是“绿色化学”的基本要求。
① 实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加铁钉和少量稀硫酸;
② 用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银;
③接触法制硫酸的设备中安装“热交换器”和锅炉,利用余热预热冷原料气和蒸气发电; ④工业合成氨中分离产物得到氢气和氮气再循环使用。
上述主要不是从“绿色化学”角度考虑的是 ( )
A.只有① B.②④ C.③④ D.②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com