
题目列表(包括答案和解析)
48.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
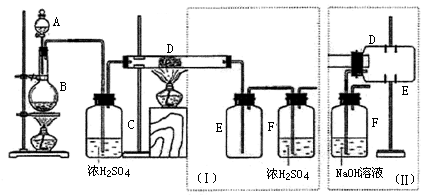
(1)B中反应的化学方程式为:___________________________________________________;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:
_______________________________________________________________。
(3)D中反应化学方程式为:________________________________。
(4)装置(Ⅰ)的主要缺点是:
________________________________________________________ 。
(5)装置(Ⅱ)的主要缺点是:_____________________________。
如果选用此装置来完成实验,则必须采取的改进措施是:
__________________________________________________________
47.用下面积几种方法可以制得Fe(OH)2沉淀:
方法1.用不含Fe3+的FeSO4溶液与用不含氧气的用蒸馏水配制的NaOH溶液反应制备,
1).用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入_________________
2).除去蒸馏水中溶解的氧气常采用___________ 的方法。
3).生成白色的Fe(OH)2沉淀的操作是用长滴管吸取不含氧气的NaOH溶液,插入FeSO4溶液下面,再挤出NaOH溶液,这样操作的理由是 _____________________________________.
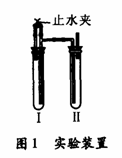 方法2.在如图1的装置中,用NaOH溶液、铁屑,稀硫酸等试剂制备,
方法2.在如图1的装置中,用NaOH溶液、铁屑,稀硫酸等试剂制备,
1)在试管Ⅰ里加入的试剂是______________________________
2).在试管Ⅱ里加入的试剂是____________________________
3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_______________________________
4).这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
______________________________________________
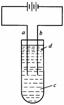 方法3.由于Fe(OH)2极易被氧化,所以实验很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
方法3.由于Fe(OH)2极易被氧化,所以实验很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为________,电极反应式为_________________________。
(2)电解液c可以是(填编号)__________________。
A.纯水 B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_________________,在加入苯之前对c应做何
简单处理?_____________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)_________
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为
____________________________________________。
46.硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸直接反应,实验中以浓硝酸分次加入到铜和稀硫酸的混合液中,加热使之完全反应,通过蒸发、析晶等操作得到硫酸铜晶体。
(1)浓硝酸所起的作用是___________________________________
(2)该反应的原理是(用化学方程式表示)
______________________________________________ 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太小,当升高温度到80-90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)用离子方程式表示速率明显加快的原理
______________________________________________ 。
Fe2(SO4)3的作用是__ 。
(4)得到的混合液用______________调节pH =2-4,使Fe3+形成Fe(OH)3沉淀而除去,且Fe(OH)3可以循环使用。
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
|
|
实 验 一 |
实 验 二 |
|
主要优 点 |
|
|
|
主要缺 点 |
|
|
45. 某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质。请回答下列问题:
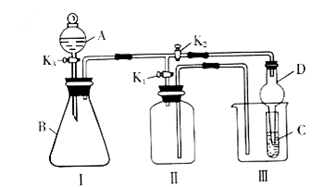

(1) 利用装置Ⅰ制取气体,生成气体的反应应具备的条件是
_________________________________________________________________。
装置Ⅲ中仪器D在实验中的作用是 。
(2)利用Ⅰ、Ⅱ装置制取气体(K2关闭,K1打开)。
甲同学认为:利用Ⅱ装置可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是________________________________________________________________________。
乙同学认为:利用Ⅱ装置作简易改进(不改变仪器装置)也可以收集O2和NO等气体,但不能收集SO2等气体,改进的方法是______________________________________________,利用Ⅱ装置再作简易改进(不改变仪器装置)也可以收集SO2等气体,改进的方法是_________________________________________________________。
(3)利用Ⅰ、Ⅲ装置验证物质的性质(K2打开,K1关闭)。如设计实验证明氧化性:
KMnO4>Cl2>Br2则在A中加浓盐酸,B中加__________,C中加________。观察到C中的现象是________________________________________。
44.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
 粗盐 H2O NaOH Na2CO3 Cl2 H2
粗盐 H2O NaOH Na2CO3 Cl2 H2
10%NaOH 、16%NaCl溶液
沉渣 NaCl晶体
50%NaOH溶液
依据上图,完成下列填空:(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH值
(选填:不变、升高或下降) (2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ,
(3)如果粗盐中SO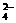 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO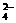 ,该钡试剂可以是 (选填a、b、c,多选扣分) a Ba(OH)2 b
Ba(NO3)2 C BaCl2
,该钡试剂可以是 (选填a、b、c,多选扣分) a Ba(OH)2 b
Ba(NO3)2 C BaCl2
(4)为有效除去Ca2+、Mg2+、SO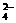 ,加入试剂的合理顺序为 (选填a,b,c多选扣分)
,加入试剂的合理顺序为 (选填a,b,c多选扣分)
a 先加NaOH,后加Na2CO3,再加钡试剂 b 先加NaOH,后加钡试剂,再加Na2CO3
c 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
43.实验室用浓盐酸和MnO2加热制Cl2并用Cl2 和Ca(OH)2 反应制少量漂白粉,现已知反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,温度稍高即发生副反应:6Cl2+2Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。现有三个学生分别设计的三套实验装置如下:
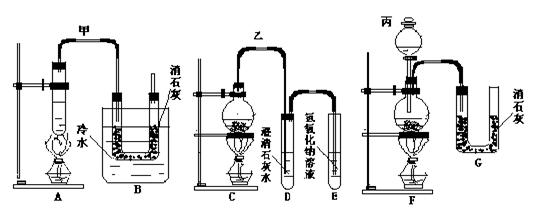
⑴请从以下六个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项填在空格内(用字母表示):
a、不易控制反应速率 b、容易控制反应速率 c、有副反应发生;
d、可防止副反应发生 e、污染环境 f、可防止环境污染
甲装置:优点 ,缺点 。
乙装置:优点 ,缺点 。
丙装置:优点 ,缺点 。
⑵请从上述甲、乙、丙装置中选取合理的组成部分,组装一套较完善的实验装置,装置各部分按气流从左到右的方向是(用字母表示) 。
⑶实验中若取12mol / L盐酸50mL与足量 MnO2 反应,最终生成Ca(ClO)2的物质的量是 0.15mol (填大于、小于或等于),其可能原因是:(假定各步反应均无反应物质损耗,且无副反应发生) 。
4.现有PH=3 的乙酸溶液,蒸馏水,石蕊试液及PH试纸,用最简便的实验方法证明乙酸为弱酸_________________________________________________________________________;
3.有学生认为2中的实验现象不足以证明碳酸的酸性比苯酚强,理由是 ______________ 改进该装置的方法是___________________________________________________________.
Ⅱ.证明乙酸为弱酸
2.装置A中反应产生的气体通入苯酚钠溶液中,实验现象是___________ 反应的离子方程式为___________________________________________________________;
1.实验前如何检验装置A的气密性?______________________________________________
大理石与乙酸溶液反应的化学方程式为____________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com