
题目列表(包括答案和解析)
2、(14分)测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算硫酸铜结晶水的含量。
请回答下列问题:
(1)从以下仪器中选出本实验不需要使用的仪器(用字母填写) ;
(A)托盘天平;(B)研钵; (C)试管夹;(D)酒精灯;(E)蒸发皿;(F)玻璃棒;(G)坩埚; (H)干燥器;(I)泥三角; (J)石棉网;(K)三角架; (L)药匙;(M)坩埚钳。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答: 。
(3)做此实验,最少应进行称量操作 次,至少加热________次。
(4)实验步骤⑥的目的是 。
(5)实验后得到以下数据:
①加热前质量:W1(容器);W2((容器+晶体);
②加热后质量:W3(容器+无水硫酸铜)
请写出硫酸铜结晶水含量,用质量分数的计算式(含Wl、W2、W3)表示:_ _____;
(6)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有: 。
A.被测样品中含有加热不挥发的杂质 B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水 D.加热前所用的坩埚未完全干燥
3.(4分)(1) 发射卫星时可用肼(N2 H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ·mol -1
N2 H4 (g) +O2 (g) = N2 (g) +2H2 O (g) △H = -543 kJ·mol -1
1、(16分) 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
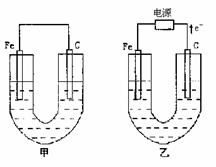 (1)若两池中均为
(1)若两池中均为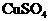 溶液,反应一段时间后
溶液,反应一段时间后
①有红色物质析出的是甲池中的_________棒,
乙池中的________棒。
②乙池中阳极的电极反应式是_________________。
(2)若两池中均为饱和NaCl溶液
①写出乙池中总反应的离子方程式______________。
②甲池中碳极上电极反应式是________________________________,
乙池碳极上电极反应属于___________(填氧化反应、还原反应)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去。这是因为过量的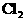 将生成的
将生成的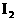 又氧化。若反应的
又氧化。若反应的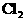 和
和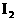 物质的量之比为5:1,且生成两种酸,该反应的化学方程式为____________________________________。
物质的量之比为5:1,且生成两种酸,该反应的化学方程式为____________________________________。
④若乙池转移0.02mol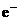 后停止实验,池中溶液体积是200mL,则溶液混匀后的pH=____。
后停止实验,池中溶液体积是200mL,则溶液混匀后的pH=____。
8、在容器固定的密闭容器中存在如下反应:
A(g)+3B(g)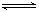 2C(g);DH<0
2C(g);DH<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断一定错误的是
A. 图Ⅰ研究的是压强对反应的影响,且乙的压强较高
B. 图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C. 图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D. 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
7、下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol / L氨水与10 mL 0.1 mol / L盐酸混合,
c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 10 mL 0.1 mol / L NH4Cl溶液与5 mL 0.2 mol / L NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol / L CH3COOH溶液与5 mL 0.2 mol / L NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol / L CH3COONa溶液与6 mL 1 mol / L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
6、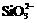 下列各组离子在指定条件下一定不能大量共存的是
下列各组离子在指定条件下一定不能大量共存的是
① 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
② c (H+)=0.lmol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
③ 能使碘化钾淀粉试纸变蓝的溶液中: Na+、NH4+、S2-、Br-
④ 由水电离出的c(H+)= 10-2mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO3-
⑤ 在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
⑥ 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
A.①②③ B.①③⑥ C.③④⑤⑥ D.②③④⑤
5、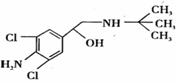 去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如右图,则它可能发生的化学反应有:
去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如右图,则它可能发生的化学反应有:
① 酯化反应 ② 取代反应 ③ 氧化反应 ④ 消去反应
A.②④ B.②③
C.①②③ D.①②③④
4、有五瓶溶液分别是:① 10 mL 0.60 mol·L-1 NaOH水溶液,② 20 mL 0.50 mol·L-1 H2SO4水溶液,③ 30 mL 0.40 mol·L-1 HCl水溶液,④ 40 mL 0.30 mol·L-1 HAc水溶液,⑤ 50 mL 0.20 mol·L-1 蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
A. ①>②>③>④>⑤ B. ②>①>③>④>⑤
C. ②>③>④>①>⑤ D. ⑤>④>③>②>①
3、列说法正确的是(N表示阿伏加德罗常数的值) A.28g氮气所含有的原子数目为N B.4g金属钙变成钙离子时失去的电子数目为0.1N C.lmol甲烷的质量与N个甲烷分子的质量之和相等 D.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为N
2、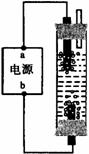 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A. a为正极,b为负极;NaClO和NaCl
B. a为负极,b为正极;NaClO和NaCl
C. a为阳极,b为阴极;HClO和NaCl
D. a为阴极,b为阳极;HClO和NaCl
1、下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
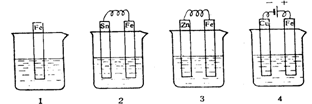
A. 4>2>1>3 B. 2>1>3>4 C. 4>2>3>1 D. 3>2>4>1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com