
题目列表(包括答案和解析)
4.下列实验操作或对实验事实的叙述不正确的是 ( )
A.用酸式滴定管最取20.00mL 0.1mol·L-1 KMnO4溶液
B.用氨水除去Mg2+溶液中的Al3+
C.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
D.用稀HNO3清洗做过银镜反应实验的试管
3.下列事实与胶体性质无关的是 ( )
A.FeCl3溶液用于止血 B.硅胶的电泳现象
C.明矾用于净水 D.药皂里加硫
1.某地发生了食用熟牛肉中毒事件,导致四个死亡、一百多人中毒。经过对该牛肉的检测,发现其中某盐的含量比国家标准允许的含量高800多倍,则该盐可能是 ( )
A.NaNO2 B.NaNO3 C.NaCl D.BaSO4
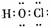
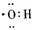 2.下列化学用语表示错误的是 ( )
2.下列化学用语表示错误的是 ( )
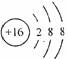
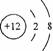 A.次氯酸电子式 B.氢氧根电子式
A.次氯酸电子式 B.氢氧根电子式
C.镁离子结构示意图 D.硫离子结构示意图
23.(8分)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
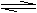 CO+H2O(g) CO2+H2,此时有
CO+H2O(g) CO2+H2,此时有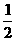 的CO转化为CO2。
的CO转化为CO2。
(1)该平衡混合物中CO2的物质的量分数为 。
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率
(填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为 。
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号)
A.16.67% B.27.55% C.33.3% D.36.8%
22.(13分)为了探究铜与浓硫酸的反应,选用以下装置
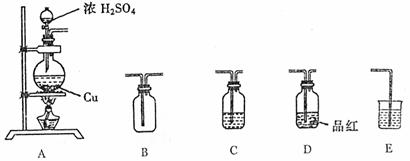
(1)装置A中发生反应的化学方程式 。
(2)若要使B中收集满干燥的SO2气体(应能证实B中已收集满)请写出上述装置的连接顺序: 接 接 接 接 。
(3)C和E装置中所盛装的试剂名称为C E ;E的作用是
。
(4)证明B中已收集满SO2的方法是 .
(5)实验中,取一定质量的铜片和一定体积、浓度的18mol·L-1的浓硫酸共热,至反应停止,发现反应器中仍有铜片剩余,此时溶液中是否还会有一定量的酸剩余,
(填“有”或“没有”),说明分析理由
。
20.(9分)A、B、C、D、E为五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的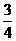 倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
(1)写出下列元素的元素符号:B ;D 。
(2)C与E形成化合物时化学键的类型是 。
(3)D与C的氧化物水化物在溶液中反应的离子方程式为
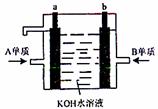
(4)用A元素的单质和B元素的单质制成的新型化学
电源已在宇宙飞船中使用。如右图所示,两个电
极均由多孔性材料制成,气体由空隙中通入,并
在电极表面放电。①a是 极。②b极的
电极反应式为:
。
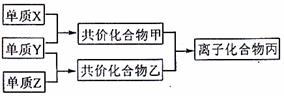 21.知周期元素的单质X、Y、Z在通常状况下均为气态,并存在下列转化关系(反应条件略去):
21.知周期元素的单质X、Y、Z在通常状况下均为气态,并存在下列转化关系(反应条件略去):
已知:在常见双原子单质分子中,X分子含共价键最多;甲分子含10个电子,乙分子含18个电子。
 回答下列问题:
回答下列问题:
(1)X的电子式是 。
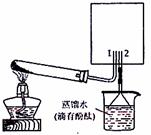
(2)实验室可用下图所示装置(缺少收集装置,
夹持固定装置略去)制备并收集甲。
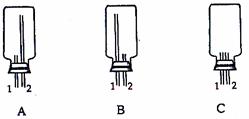 ①从下列装置中选出上图方框内收集甲的装置是
。
①从下列装置中选出上图方框内收集甲的装置是
。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
(3)磷在单质Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外电子层均满足8电子结构,丁的化学式是 。
19.(8分)已知反应AgF+Cl2+H2O→AgCl↓+AgClO3+HF+O2(未配平)
(1)若Cl2的化学计量数为a,则AgF的化学计量数为 。
(2)若AgClO3的化学计量数为b,O2的化学计量数为c,则AgCl的化学计量数为
,判断的依据是 。
(3)若O2的化学计量数为1时,反应中电子转移的总量为 mol。
18.下列说法正确的是 ( )
A.pH=2与pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.0.2mol·L-1与0.1mol·L-1醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
|
16.已知:2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O
Cl2+2FeCl2 2FeCl3;2KI+2FeCl3 2KCl+I2+2FeCl2
下列判断正确的是 ( )
A.氧化性:MnO4->Cl2>I2>Fe3+
B.还原性:Fe2+>I->Cl-
C.Fe3+只有氧化性,Fe2+只有还原性
D.FeCl3能使湿润的淀粉KI试纸变蓝
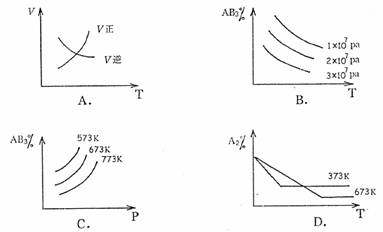
 17.对于可逆反应A2(g)+3B2(g) 2AB3(g);△H<0,下列图像正确的是( )
17.对于可逆反应A2(g)+3B2(g) 2AB3(g);△H<0,下列图像正确的是( )
14.用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否。下列类推结论中正确的是 ( )
A.Na失火不能用CO2灭火,K失火不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,也用电解熔解AlCl3的方法制取金属铝
C.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
|
3CO下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中生生成2mol AlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com