
题目列表(包括答案和解析)
5.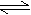 一定条件,反应CO2(g)
+ C (s) 2CO(g);△H>0达到平衡状态。下列说法正确的是
一定条件,反应CO2(g)
+ C (s) 2CO(g);△H>0达到平衡状态。下列说法正确的是
A.平衡混合气中,CO物质的量浓度一定是CO2物质的量浓度的2倍
B.若升高温度,CO2的转化率增大
C.若增大CO2的浓度,△H增大
D.若增大压强,平衡不移动
4.(往届)瑞典皇家科学院诺贝尔奖评委会10日宣布,德国科学家格哈德·埃特尔因为在表面化学研究领域作出开拓性贡献而获得2007年诺贝尔化学奖。格哈德·埃特尔研究的内容能够帮助我们理解铁为什么会生锈、燃料电池如何工作、汽车里的催化剂如何工作。则下列相关说法正确的是
A.含碳生铁在发生电化学腐蚀的时候铁一般做正极
B.在氨的合成反应中,采用高温有利于氨生成
C.工业制硫酸的接触室中热交换器其主要作用:一方面使即将参加反应的气体达到一定温度,另一方面降低SO3的温度
D.SO2氧化为SO3时需使用V2O5催化剂,这样可以提高SO2的转化率
4、(应届)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)<c(SO42-) B.c(NH4+)>c(SO42-)
C.2c(NH4+)=c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
3.已知1.2 g C(石墨)不完全燃烧生成CO,放出11.1 kJ热量,继续燃烧又放出28.3 kJ热量。则能表示C(石墨)燃烧热的热化学方程式为( )
A.C(石墨 s)+1/2O2(g)=CO(g);△H=-11.1kJ·mol-1
B.C(石墨 s)+1/2O2(g)=CO(g);△H=-111kJ·mol-1
C.C(石墨 s)+O2(g)=CO2(g);△H=-394kJ·mol-1
D.C(石墨 s)+O2(g)=CO2(g);△H=-283kJ·mol-1
2、氯气是一种重要的工业原料。工业上利用反应3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
1、“嫦娥一号”探月卫星已于今年十月二十四日腾空而起,直奔月球。据科学家预测,月球的土壤中吸附着数百万吨的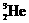 ,每百吨
,每百吨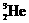 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A  原子核内含有4个质子 B
原子核内含有4个质子 B 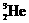 和
和 互为同位素
互为同位素
C 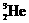 原子核内含有3个中子 D
原子核内含有3个中子 D  的最外层电子数为2,所以
的最外层电子数为2,所以 具有较强的金属性
具有较强的金属性
23.(8分)将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
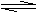 CO+H2O(g) CO2+H2,此时有
CO+H2O(g) CO2+H2,此时有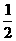 的CO转化为CO2。
的CO转化为CO2。
(1)该平衡混合物中CO2的物质的量分数为 。
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率
(填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为 。
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号)
A.16.67% B.27.55% C.33.3% D.36.8%
22.(13分)为了探究铜与浓硫酸的反应,选用以下装置
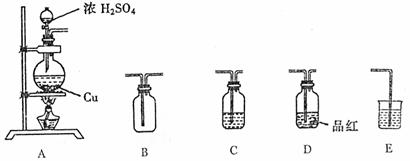
(1)装置A中发生反应的化学方程式 。
(2)若要使B中收集满干燥的SO2气体(应能证实B中已收集满)请写出上述装置的连接顺序: 接 接 接 接 。
(3)C和E装置中所盛装的试剂名称为C E ;E的作用是
。
(4)证明B中已收集满SO2的方法是 .
(5)实验中,取一定质量的铜片和一定体积、浓度的18mol·L-1的浓硫酸共热,至反应停止,发现反应器中仍有铜片剩余,此时溶液中是否还会有一定量的酸剩余,
(填“有”或“没有”),说明分析理由
。
20.(9分)A、B、C、D、E为五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的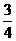 倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
(1)写出下列元素的元素符号:B ;D 。
(2)C与E形成化合物时化学键的类型是 。
(3)D与C的氧化物水化物在溶液中反应的离子方程式为
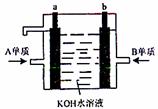
(4)用A元素的单质和B元素的单质制成的新型化学
电源已在宇宙飞船中使用。如右图所示,两个电
极均由多孔性材料制成,气体由空隙中通入,并
在电极表面放电。①a是 极。②b极的
电极反应式为:
。
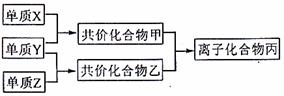 21.知周期元素的单质X、Y、Z在通常状况下均为气态,并存在下列转化关系(反应条件略去):
21.知周期元素的单质X、Y、Z在通常状况下均为气态,并存在下列转化关系(反应条件略去):
已知:在常见双原子单质分子中,X分子含共价键最多;甲分子含10个电子,乙分子含18个电子。
 回答下列问题:
回答下列问题:
(1)X的电子式是 。
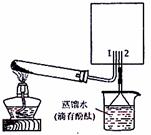
(2)实验室可用下图所示装置(缺少收集装置,
夹持固定装置略去)制备并收集甲。
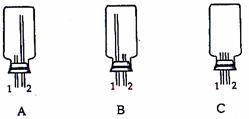 ①从下列装置中选出上图方框内收集甲的装置是
。
①从下列装置中选出上图方框内收集甲的装置是
。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
(3)磷在单质Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外电子层均满足8电子结构,丁的化学式是 。
19.(8分)已知反应AgF+Cl2+H2O→AgCl↓+AgClO3+HF+O2(未配平)
(1)若Cl2的化学计量数为a,则AgF的化学计量数为 。
(2)若AgClO3的化学计量数为b,O2的化学计量数为c,则AgCl的化学计量数为
,判断的依据是 。
(3)若O2的化学计量数为1时,反应中电子转移的总量为 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com