
题目列表(包括答案和解析)
12.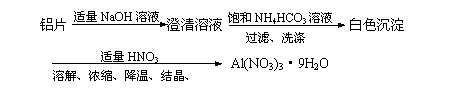 实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
实验室制备硝酸铝晶体[Al(NO3)3·9H2O]可使用下列方法:
|
A.2Al+2OH-+2H2O = 2AlO2-+3H2↑
B.2HCO3-+2AlO2-+H2O = 2CO2↑+2Al(OH)3↓
C.NH4++AlO2-+2H2O = NH3·H2O+ Al(OH)3↓
D.3H++ Al(OH)3 = Al3++3H2O
化学测试卷
第II卷(非选择题 共60分)
11.25℃时,pH=2某酸(HA)与pH=12某碱(BOH)等体积混合后,混合液的pH=10,
下列描述中正确的是
A.若两者中有一种为强电解质,则一定是BOH
B.若HA是强酸,混合液中离子浓度关系一定是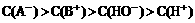
C.若混合液中存在离子水解,则一定是A-水解
D.两者混合后,BOH有可能过量
9. 一定条件下,可逆反应C(s)
+ CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
一定条件下,可逆反应C(s)
+ CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量;
③缩小反应体系的体积; ④减少体系中CO的量。
上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
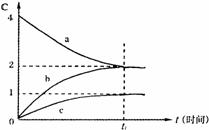 10.800℃时,a、b、c三种气态物质的浓度随着时间的
10.800℃时,a、b、c三种气态物质的浓度随着时间的
变化情况如下图所示。由图分析不能得出的结论是
|
B.t1后,若升高温度,正反应速率增大
C.t1后,若升高温度,a的转化率增大
D.t1后,若增大压强,混合气体的平均相对分子质量增大
8.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
|
||
|
X |
|
|
|
|
Y |
Z |
|
|
|
|
|
W |
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,一定条件下可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①② C.①②③ D.①②③④
7.MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2=2H2O,则下列有关该电池的说法正确的是
A.该电池负极的反应为:H2+CO32--2e-=H2O+CO2
B.该电池的正极的反应式为:4OH-+4e-=O2+2H2O
C.放电时CO32-向正极移动
D.随着反应的进行,CO32-在不断消耗
6.向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是
①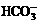 ②
②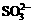 ③OH- ④Fe2+
③OH- ④Fe2+
A.①② B.③④ C.①②③ D.①②③④
5.某无色透明溶液能与铝反应放出H2,则该溶液中可大量共存的离子是
A.OH- Mg2+ 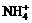 Cl- B.Cl- K+ Na+ Ba2+
Cl- B.Cl- K+ Na+ Ba2+
C.Ba2+ Cl- Cu2+  D.H+ Na+
D.H+ Na+ 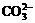 Cl-
Cl-
4.NA代表阿伏加德罗常数的值,下列说法正确的是
A.在标准状况下,VL水含有的氧原子个数为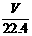 NA
NA
B.CO2通过Na2O2使其增重bg时,反应中转移的电子数为bNA/44个
C.常温下,1L 1 mol·L-1的乙酸溶液中,所含CH3COO-为NA
D.常温常压下,0.1 mol氖气含有的电子数为NA
3.把硫和强碱(如NaOH)加热至沸,反应后,硫转化为S2-和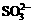 ,则反应的S和生成的S2-、
,则反应的S和生成的S2-、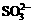 的物质的量之比为
的物质的量之比为
A.2 :1 :1 B.3 :2 :1 C.3 :1 :2 D.4 :1 :3
2.pH与体积均相同的氢氧化钠溶液和氨水,分别与同浓度、同体积的AlCl3溶液反应,生成沉淀的质量也相同,则可能是
A.AlCl3过量 B.AlCl3的量恰好与氢氧化钠完全反应
C.两种碱均过量 D.AlCl3的量恰好与氨水完全反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com