
题目列表(包括答案和解析)
17.(8分)
|
(2): F : F : (2分)
2HCl H2↑+Cl2↑(2分)
(3)Cu+H2O2+2H+ Cu2++2H2O(2分)
17.(8分)
X、Y、Z为前三周期元素形成的微粒,它们的电子总数相等。已知X为负二价双原子阴离子;Y为双原子分子;Z常温为液体,其水溶液呈弱酸性。
(1)X与钠离子组成的离子化合物常温下跟水反应产生一种可助燃的气体,该反应的化学方程式为:
。
(2)若Y为遇水就能剧烈反应的单质,则Y的电子式为 ;
若Y为化合物,用石墨电极电解Y的水溶液,其电解反应为:
。
(3)若在稀硫酸中加入铜粉后再加Z,发现铜粉逐渐溶解,该反应的离子方程式为:
。
16.(14分)
(1)NO2(1分) H2O(1分)
|
(3)①4HNO3(浓)+C CO2↑+4NO2↑+2H2O(2分)
②3NO2+H2O 2HNO3+NO(2分)
③4NO+3O2+2H2O 4HNO3(2分)
(4)Al+4OH--3e- AlO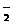 +2H2O(2分) 2Al+2OH-+2H2O
+2H2O(2分) 2Al+2OH-+2H2O 2AlO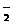 +3H2↑(2分)
+3H2↑(2分)
16.(14分)
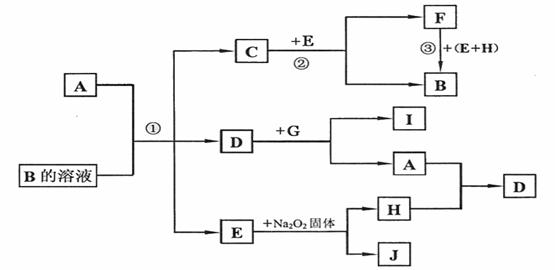 下面是中学化学常见物质A-J的反应转化关系图。其中A、G、H为单质,其余为化合物;常温下C、D、F为气体,有关反应条件均已略去。
下面是中学化学常见物质A-J的反应转化关系图。其中A、G、H为单质,其余为化合物;常温下C、D、F为气体,有关反应条件均已略去。
请回答下列问题:
(1)物质C、E的化学式分别为 ; 。
(2)物质D的结构式为 ;G可能的化学式为 。
(3)反应①②③的化学方程式分别为(需条件的,要注明反应条件):
① ;
② ;
③ 。
(4)将金属铝片和A的某种同素异形体作电极,一定浓度的J的水溶液作电解质溶液构成原电池,则原电池的负极的电极反应为:
;
原电池总反应的离子方程式为:
。
15.(6分)
(1)3.65;65% (2)①
15.(9分)
恒温、恒压(1.01×105Pa)下,将2.0molSO2与a molO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
 2SO2(g)+O2(g)
2SO3(g);△H<0
2SO2(g)+O2(g)
2SO3(g);△H<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,
则a= ;平衡时SO2的转化率为 。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8mol。
T1与T2的关系是: (选填序号)。
①.T1>T2 ②.T1<T2 ③.T1=T2
14.(9分)
(1)合理(1分)
(2)用磁铁吸引,若能吸附,说明有铁生成(2分,只回答用磁铁吸引,给1分;其它答案合理且完全正确给1分)
(3)NaOH溶液(1分) 取少量样品放入试管,加入NaOH溶液,(1分)若有气泡产生,说明该熔融物中有铝(1分)
2Al+2NaOH+6H2O 2Na[Al(OH)3]+3H2↑(3分)
14.(9分)
某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发同耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1 535 |
|
沸点(℃0 |
2 467 |
2 750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?
(填“合理”或“不合理”)。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:
。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含物中含有金属铝。请填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
13.(共9分)
(1)H2O、H+、SO42-中的某一种粒子能够使CuO溶解(2分)
(2)水不能使氧化铜溶解,而是另外的H+、SO42-两种粒子中的一种粒子使CuO溶解(2分)
(3)Na2SO4(或K2SO4等)(1分),稀硫酸(1分)
(4)氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O,SO42-两种粒子都不能使CuO溶解。(2分) 硝酸或盐酸等 (1分)
13. (共9分)
(共9分)
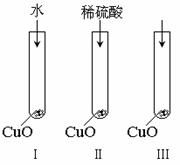
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
(1)某同学提出的假设是:
;
(2)通过实验Ⅰ可以证明: ;
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:
在Ⅲ中先加入 ,再加入 。
(4)探究结果为: 。
你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com