
题目列表(包括答案和解析)
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 。
(2)实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
21.(10分)将30.0 g某铜银合金溶于80 mL13.5 mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液的pH=0。假设反应所得气体只可能是NO2、NO或它们的混合物,反应后溶液的体积仍为80 mL。试计算:
⑴合金中银的质量分数。
⑵所得气体的组成(若为混合物,需算出各组成成分的体积)。
20.(12分)石油化工是是江苏省的支柱产业之一。丙烯是重要的化工原料,一定条件下可发生下列转化:
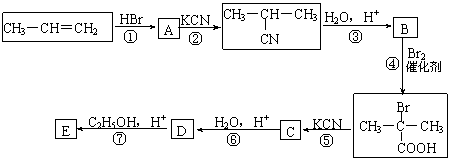
回答下列问题:
⑴A的结构简式为____________________。
⑵反应①-⑦中,属于取代反应的是___________________(填序号)。
⑶D与足量乙醇反应生成E的化学方程式为_______________________________。
⑷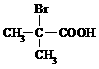 与足量NaOH溶液反应的化学方程式为___________________。
与足量NaOH溶液反应的化学方程式为___________________。
⑸B的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应的同分异构体的结构简式为:_________________________________________________________
___________________________________________________________________。
18.(10分)通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
⑴目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于_______________________________。
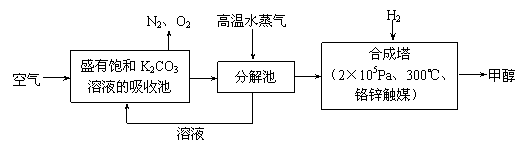 ⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为____________________________________________。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式____________________________________。
⑶小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
小李应该选用的试剂是___________________,实验时测定的数据除空气的体积外,还需要测定____________________________________________________________。
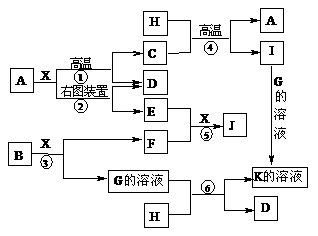
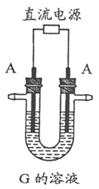 19.(10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
19.(10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
17.(10分)某实验小组同学在做铜与浓硫酸反应实验时,发现铜片反应结束后,试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有水的烧杯中,发现所得溶液为蓝色,仍然有黑色固体未溶解。
⑴由上述实验可知,原试管底部的白色固体是_____________。
⑵小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是____________________________________。
⑶为探究黑色固体的组成,小组成员上网检索,获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S都能被硝酸氧化为Cu2+和SO42-、都能在空气中灼烧生成CuO和SO2。
①写出CuS溶于浓硝酸的化学方程式:_____________________________________。
②将烧杯中黑色固体过滤并洗涤干净,加入少量浓硝酸,待固体溶解后再加入少量BaCl2溶液。该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是____________________________________________________________________。
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合物,应如何设计实验?请简要叙述:___________________________________。
16.(10分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体和胆矾晶体。其实验方案如下:
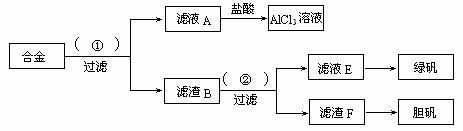
⑴所加试剂①、②分别是____________________________________。
⑵从滤液E中得到绿矾晶体的实验操作是______________________________________;从滤渣F制取胆矾的第一步操作最好采用_____________________________________。
⑶上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由__________ _____________________________________________________。你认为正确的设计方案是________________________________________________________________________
______________________________________________________________________。
15.(10分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
|
|
实验操作 |
实验现象 |
|
步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
|
步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
|
步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴ 步骤1中发生反应的离子方程式是______________________________________,过滤的目的是________________________________________________________。
⑵ 步骤2、步骤3的实验目的都是_____________________________,为达到该实验目的,还可以采取的方法是_____________________________________________。
⑶ 请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_____________________________________________________。
14.甲、乙两烧杯中各成盛有50 mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.1.8 g B.2.7 g C.3.6 g D.5.4 g
13.从石英砂制取并获得高纯硅的主要化学反应如下:
① SiO2+2C Si(粗)+2CO
Si(粗)+2CO
② Si(粗)+2Cl2 SiCl4
SiCl4
③ SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是
A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
12.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入足量的一气体X后即有沉淀生成,则X可能是
A.Cl2 B.NH3 C.HCl D.CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com