
题目列表(包括答案和解析)
3.下列叙述中正确的是 ( )
A.P4和NO2都是共价化合物
B.NaCl熔化属于化学变化
C.在CaO和SiO2晶体中,都不存在单个小分子
D.石墨转变为金刚石,结构不变
2.溶液、胶体和悬浊液这三种分散系的本质区别是 ( )
A.是否为大量分子或离子的集合体 B.能否透过滤纸或半透膜
C.分散质粒子的大小 D.能否产生丁达尔现象
1.实现下列变化时,克服微粒间作用力类型相同的是 ( )
A.二氧化硅和干冰的熔化 B.液溴和液氨的气化
C.食盐和冰的熔化 D.纯碱和金属钠的熔化
21.(10分)某研究性学习小组拟用铜屑、氧化铜的混合物与硫酸、硝酸组成的混酸反应制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含有Cu(NO3)2,反应中固体完全溶解,两种酸恰好完全反应。设固体混合物的总质量为240g,其中氧化铜的质量分数为x,试回答下列问题:
⑴所得CuSO4·5H2O晶体的质量y的表达式为: g(用x表示);
⑵若要保证固体全部溶解,混酸恰好反应,则混酸中HNO3、H2SO4的物质的量浓度之比(A): (填“A”的取值范围);
⑶若A= ,反应结束时将所得气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少g?
,反应结束时将所得气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少g?
20. X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
 已知:X+Y
已知:X+Y Z+W
Z+W
(1)Y的电子式是________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
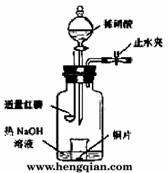
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是______________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ___________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是____________________
_________________________________________。
反应的离子方程式是_______________________________。
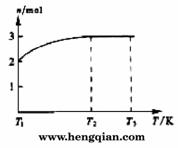 (4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。
①温度在T1-T2之间,反应的化学方程式是_________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数)______________。
19.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
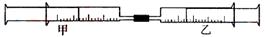
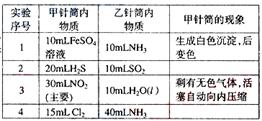
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_____。
(2)实验2甲针筒内的现象是:有___________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为_________________。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
18.某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.(1) 某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_________,反应的离子方程式为___________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
 Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸
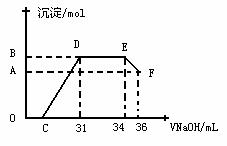
的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____上述现象说明溶液中________________结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
(4) B点对应的沉淀的物质的量为______mol,C点对应的氢氧化钠溶液的体积为_____mL。
17.(11分)硅酸盐在自然界中分布极广,几乎在所有的硅酸盐矿物中,Si原子都和4个O原子结合成四面体的[SiO4]单元(图1),图中○表示“O”,⊙表示“Si-O”),[SiO4]单元既可以是分立的,也可以和其它四面体共用顶点连接各种各样的链状结构(如图2)、环状结构(图3)
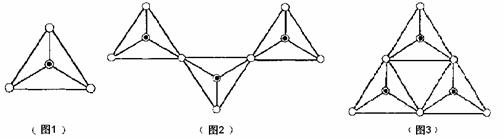
(1)形成硅氧四面体是硅与氧成键的一个重要特征,试再举两种含有[SiO4]单元的物质(要求不同种类) 。
(2)最简单的硅酸盐是硅酸钠,硅酸钠溶液中滴入酚酞显红色,用离子方程式解释其原因 ,通入CO2能使溶液的红色褪色,离子方程式 。
(3)将某些盐混进硅酸钠溶液时,盐会向上扩散长成很漂亮的树状,且树会保留金属离子的特征颜色,例如:CuSO4·5H2O和Na2SiO3溶液发生水解反应长成蓝色的树,NiSO4·7H2O则会长成绿色的树,写出加入CuSO4·5H2O长成蓝树的离子方程式:
。
(4)图1为SiO44-,图2、图3所示硅酸盐离子的符号 、
(5)由13个正四面体结合成的环状结构Si13O3722-离子中,其中有 ___________个正四面体和另外的四面体共享2个顶点。
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:
取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。
据此可推得A为 ,由此得到的结论是 。
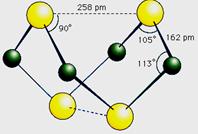
16.(10分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模如图所示,图中部分反应条件已略去。
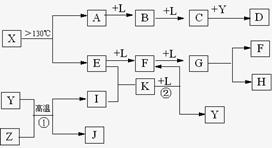
试回答下列问题
(1)写出化学式:D X 。
(2)E的电子式为: 。
(3)写出化学方程式:① ;② 。
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
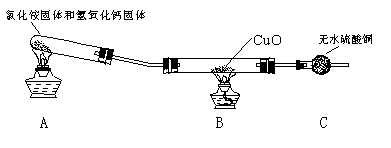
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式
___________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com