
题目列表(包括答案和解析)
25.(8分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
 (1)请将Au2O3之外的反应物与生成物分别填入以下空格内,并标出电子转移的方向和数目。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内,并标出电子转移的方向和数目。
(2)反应中,被还原的元素是 ,还原剂是 。
(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
24.(9分)X、Y、Z三种元素,X与氢能形成气态XH4,其中X的质量分数为75%,且X与Y能形成XY2型化合物。Y的核内质子数和中子数相等 ,在Y的氢化物中,Y的质量分数为88.9%,Z是最高价氧化物的水化物是酸性最强的酸。
(1)X元素所形成的同素异形体中硬度最大的是 (填名称),它属于 晶体。
(2)Y的氢化物属于 晶体,它的电子式是 。
(3)Z元素位于周期表第 周期第 族,它的氢化物是 (填“极性”或“非极性”)分子。
(4)X与Z形成的化合物其分子的空间构型是 ,它的晶体属于 晶体。
23.(12分)电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源
极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水原理示意图。电极反应为:
阳极 ,
阴极 。
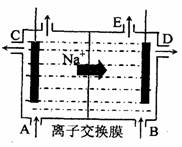 下列说法中正确的是
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导
电性
C.标准状况下每生成22.4L Cl2,便产生2mol
NaOH
D.向电解后的阳极室溶液中加适量盐酸,可以
恢复到电解前的物质的浓度
22.(4分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.652kJ的热量。
(1)该反应的热化学方程式是 。
(2)又已知H2O(l)==H2O(g);△H=-44kJ·mol-1,由16g液态肼与液态过氧化氢反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
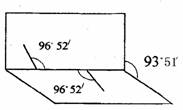
21.(7分)已知H2O2分子的结构如图所示:H2O2分子
不是直线型,两个H原子犹如在半展开的书的两页
上,O原子则在书的夹缝上,书页夹角为93°51′,
而两个O-H键与O-O键的夹角均为96°52′。试回答:
(1)写出H2O2分子的结构式 。
(2)H2O2分子内含有 键(填“极性键”或“非极性键”)。
(3)在下列反应中,体现了H2O2的哪些性质
2H2O2==2H2O+O2↑ 。
H2O2+SO2== H2SO4 。
H2O2+Cl2==2HCl+O2 。
Na2O2+2HCl==H2O2+2NaCl 。
19.下列关于实验现象的描述不正确的是 ( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液时,锌片溶解,电极反应:Zn-2e-=Zn2+
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入氯化铜溶液,气泡放出速率加快
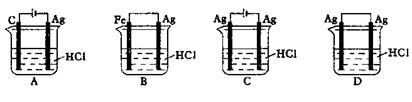 20.某同学为了使反应2HCl+2Ag
20.某同学为了使反应2HCl+2Ag 2AgCl+H2↑能进行,设计了如下图示的四个实验,你认为可行的方案是 ( )
第Ⅱ卷(非选择题 共60分)
18.已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+====Fe3++Ce3+、Sn2++2Fe3+===2Fe2++Sn4+由此可以确定Fe2+、Sn2+、Ce3+三种离子的还原性由强到弱的顺序是 ( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
17.2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知丙烷的燃烧热为:2221.5kJ·mol-1,正丁烷的燃烧热为:2878kJ·mol-1,异丁烷的烯烧热为:2869.6kJ·mol-1,下列有关说法正确的是( )
A.奥运火炬燃烧时的能量转化主要是化学能转变为热能
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热也多
C.正丁烷比异丁烷稳定
D.丙烷燃烧的热化学方程式为:C3H8+5O2==3CO2+4H2O;△H=-2221.5kJ·mol-1
16.pH=a某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则电解质可能是 ( )
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
15.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱性条件下生成ClO,把二价镍氧化成三价镍。以下说法正确的是 ( )
A.可用铁做阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl-2e-=Cl2↑
D.1 mol二价镍全部转化成三价镍时,外电路中通过了2mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com