
题目列表(包括答案和解析)
6. 下述实验能达到预期目的的是( )
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失 |
证明此溶液是Na2SiO3溶液 |
|
D |
向硫酸铜溶液中通入H2S产生沉淀 |
证明硫酸与氢硫酸的酸性强弱 |
5.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
4.设NA为阿伏加德罗常数,下列说法正确的是( )
A.23g钠在氧气中完全燃烧失去电子数为0.5NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为22. 4L
C.标准状况下,11.2L的SO3所含分子数为0.5NA
D.在SiO2晶体中,若含有1 mol Si原子,则Si-O键数目为4NA
3.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼, 冶炼方法与其活泼性有关
2.分类方法在化学学科的发展中起了非常重要的作用。下列分类合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
1.食品检验是保证食品安全的措施,下列不属于食品安全检测指标的是( )
A.三聚氰胺的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.淀粉的含量
22、 (8分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1
(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
21、(12分)中学化学中几种常见物质的转化关系如下:
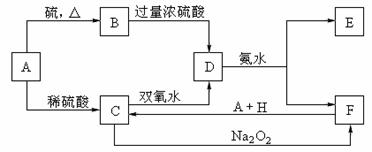 将D溶液滴入沸水中
将D溶液滴入沸水中
可得到以F为分散质
的红褐色胶体。请回答
下列问题:
(1)红褐色胶体E粒子
直径大小的范围:
。
(2)A、B、H的化学式:
A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
20、(8分)碱式碳酸镁有多种不同的组成,
如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。某研究性学习小组同学为确定某种碱式碳酸镁的组成,设计下图所示的实验装置。
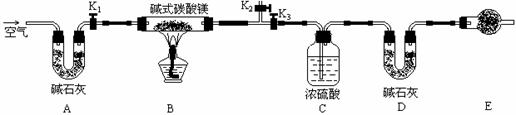
(1) 实验步骤:
(2) ①按上图(夹持仪器未画出)组装好实验装置后,首先进行的_______________
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作_________________ 。
E处干燥管盛放的药品是_______________ 。
②称取碱式碳酸镁样品m1g,并将其放入硬质玻璃管中;称量;装浓硫酸的洗气瓶C的质量为m2 g,装碱石灰的U型管D的质量为m3 g。
③打开活塞__________,关闭___________,缓缓鼓入空气数分钟。
④关闭活塞__________,打开___________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为m4 g;U型管D的质量为m5 g。
实验测得数据如下:m1 =31g,m2=87.6g,m3=74.7g,m4 =89.4g,m5=87.9g,计算推导:该碱式碳酸镁的化学式为_____________________________________。
(2)关于该实验方案,以下说法你认为正确的是________________。(填字母)
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碳酸镁的组成
C.该实验装置也可用于确定天然碱[aNa2CO3.bNaHCO3.cH2O(a、b、c为正整数)]的化学组成
19、 (8分)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
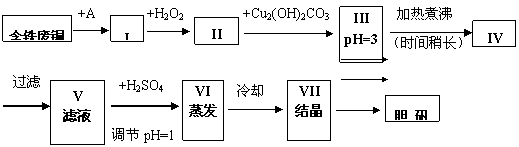
pH值控制可参考下列数据
|
物 质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。a.稀H2SO4 b.浓H2SO4/ D c.浓FeCl3溶液 d.浓HNO3
⑵ I中加H2O2的目的_____________________________________________。
⑶ II中加Cu2(OH)2CO3的目的是___________________________________________;
其优点是____________________________________________________________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是_____________。
若你是该工程师,将对所加的A物质作何改进?请提出建议________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com