
题目列表(包括答案和解析)
5.海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
4.设NA为阿伏加德罗常数,下列说法正确的是( )
A.23g钠在氧气中完全燃烧失去电子数为0.5NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为22. 4L
C.标准状况下,11.2L的SO3所含分子数为0.5NA
D.在SiO2晶体中,若含有1 mol Si原子,则Si-O键数目为4NA
3.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼, 冶炼方法与其活泼性有关
2.分类方法在化学学科的发展中起了非常重要的作用。下列分类合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
1.食品检验是保证食品安全的措施,下列不属于食品安全检测指标的是( )
A.三聚氰胺的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.淀粉的含量
20.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有一种为金属,X的核外电子排布式为nsnnpn,Z的最外层电子数是其电子层数的2倍, Y原子与Z原子的最外层电子数之和为9,且Y和W单质都可与烧碱溶液反应,请回答以下问题:
(1)Y、Z、W的原子半径由大到小的顺序是 (填元素符号)
(2)XZ2的电子式是 ,空间结构为 ,
形成晶体时属于 晶体。
(3)Y的价电子排布式是 ,工业上生产单质Y的原理是________
((用化学反应方程式表示)
(4)试用勒夏特列原理解释用饱和食盐水收集W单质的原理

 2009届安溪八中高三化学第一次月考试卷
2009届安溪八中高三化学第一次月考试卷
A[有机化学基础模块]
20.根据图示填空
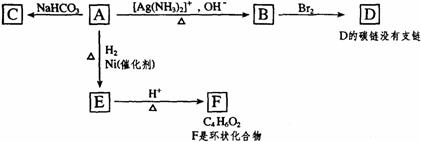
(1)化合物A含有的官能团是 。
(2)1mol A与2mol H2反应生成1molE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)由E生成F的反应类型是 。
B.[物质结构与性质模块]
19、H2还原CuO反应不完全时,得到Cu、CuO、Cu2O的固体混和物,某化学兴趣小组同学为探究上述固体的成分进行了如下实验:
(1)取一定量的均匀固体混合物A,将其分成两等份。
(2)取其中一份用足量的H2还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀HNO3,固体恰好完全溶解,同时收集到标况下NO气体为2.24L。请回答下列问题:
(1)A中n(Cu)+n(Cu2O)= 。
(2) A中n(CuO)的取值范围是 。
(3)试计算所用稀HNO3的物质的量浓度。
18.有A、B、C三种常见的短周期单质,A为自然界中最硬的单质,B可与冷、浓硫酸发生钝化,C为淡黄色的固体。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液显强酸性;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图,请回答:

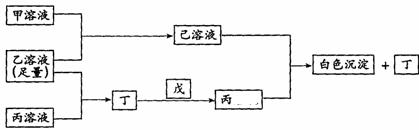
(1)写出C元素的原子结构示意图__________,写出戊的电子式__________;
(2)乙溶液呈强酸性的原因_________________________(用电离方程式表示);丙溶液呈碱性的原因____________________________;(用化学反应方程式表示)
(3)写出有关反应的离子方程式
①乙溶液+丙溶液→丁_______________________________________________
② 己溶液+丙溶液→丁_______________________________________________
17.I.粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要仪器的名称为 ▲ 。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用60 mL 1 mol/L-1的NaCl溶液,配制过程中用托盘天平称取的精盐质量为 ▲ ,配制该溶液所需的主要仪器是 ▲ 。
II. 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(填字母)。
(2)写出步骤③中发生反应的离子方程式
(3)洗涤沉淀的操作是
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com