
题目列表(包括答案和解析)
4.已知Zn(s)+H2SO4(aq)== ZnSO4(aq)+H2(g),△H<0;则下列关于该反应的叙述不正确的是: ( )
A、该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
B、下述热化学方程式中的△H的值与反应物的用量无关
C、该反应的化学能可以转化为电能
D、反应物的总能量高于生成物的总能量
3.下列各离子组中,能在水溶液中大量共存,当滴加稀硫酸后则不能大量共存的是
( )
A.Na+、Mg2+、Cl-、I- B.Fe2+、Ba2+、S2-、Cl-
C.Na+、Al3+、Cl-、HCO3- D.K+、Fe2+、Cl-、NO3-
2.在密闭容器中,反应2X (g) + Y (g) 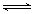 3Z (g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是
(
)
3Z (g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是
(
)
A.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡不移动
D.正、逆反应速率都增大,平衡不移动
1.以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是 ( ) A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
20.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有一种为金属,X的核外电子排布式为nsnnpn,Z的最外层电子数是其电子层数的2倍, Y原子与Z原子的最外层电子数之和为9,且Y和W单质都可与烧碱溶液反应,请回答以下问题:
(1)Y、Z、W的原子半径由大到小的顺序是 (填元素符号)
(2)XZ2的电子式是 ,空间结构为 ,
形成晶体时属于 晶体。
(3)Y的价电子排布式是 ,工业上生产单质Y的原理是________
((用化学反应方程式表示)
(4)试用勒夏特列原理解释用饱和食盐水收集W单质的原理

 2009届安溪八中高三化学第一次月考试卷
2009届安溪八中高三化学第一次月考试卷
A[有机化学基础模块]
20.根据图示填空
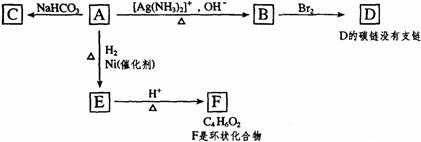
(1)化合物A含有的官能团是 。
(2)1mol A与2mol H2反应生成1molE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)由E生成F的反应类型是 。
B.[物质结构与性质模块]
19、H2还原CuO反应不完全时,得到Cu、CuO、Cu2O的固体混和物,某化学兴趣小组同学为探究上述固体的成分进行了如下实验:
(1)取一定量的均匀固体混合物A,将其分成两等份。
(2)取其中一份用足量的H2还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀HNO3,固体恰好完全溶解,同时收集到标况下NO气体为2.24L。请回答下列问题:
(1)A中n(Cu)+n(Cu2O)= 。
(2) A中n(CuO)的取值范围是 。
(3)试计算所用稀HNO3的物质的量浓度。
18.有A、B、C三种常见的短周期单质,A为自然界中最硬的单质,B可与冷、浓硫酸发生钝化,C为淡黄色的固体。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液显强酸性;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图,请回答:

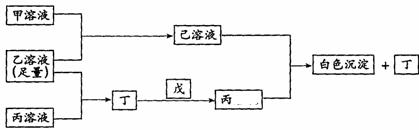
(1)写出C元素的原子结构示意图__________,写出戊的电子式__________;
(2)乙溶液呈强酸性的原因_________________________(用电离方程式表示);丙溶液呈碱性的原因____________________________;(用化学反应方程式表示)
(3)写出有关反应的离子方程式
①乙溶液+丙溶液→丁_______________________________________________
② 己溶液+丙溶液→丁_______________________________________________
17.I.粗盐经提纯后得到NaCl溶液,再经蒸发、结晶、烘干得精盐。
①蒸发操作中使用到的仪器除铁架台(带铁圈)外,还需要仪器的名称为 ▲ 。
②该同学将所得精盐配成溶液,用于另一实验。实验中需要用60 mL 1 mol/L-1的NaCl溶液,配制过程中用托盘天平称取的精盐质量为 ▲ ,配制该溶液所需的主要仪器是 ▲ 。
II. 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(填字母)。
(2)写出步骤③中发生反应的离子方程式
(3)洗涤沉淀的操作是
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
。
16、在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为
ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为b moL。
下列叙述中正确的是( )
A.溶质的质量分数为ω=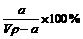
B.溶质的物质的量浓度
C.溶液中c(OH-)=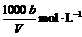
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
第Ⅱ卷(必考题37分,选考题15分,共52分)
必考题(共3题)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com