
题目列表(包括答案和解析)
2.设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
1.下列说法不正确的是( )
A.1mol氧气含有12.04×1023个氧原子,在标准状况下占有体积22.4L
B.1mol臭氧和1.5mol氧气含有相同的氧原子数
C.等体积、浓度均为1mol/L的磷酸和盐酸,电离出来的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3
22.有一瓶(约100mL)硫酸和硝酸的混合溶液,取出10.00mL该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得4.66g沉淀。滤液跟2.00mol/LNaOH溶液反应,共用去35.00mL碱液时恰好中和。试完成下列
(1)则混合溶液中硝酸的物质的量浓度 c (HNO3) = mol/L
(2)另取10.00mL原混酸溶液,加入1.60g铜粉共热,反应的离子方程式为:
在标准状况产生的气体体积为 mL。
21.已知下列两个热化学方程式;
H2(g)+ O2(g)===H2O(1); △H=-285.0kJ/mol
O2(g)===H2O(1); △H=-285.0kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
20.在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
 时间 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
C(N2O4) |
0.20 |
a |
0.10 |
c |
d |
e |
|
C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率
为 。
(3)该反应的平衡常数表达式K= ,在80℃时该反应的平衡常数K值为 (保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
(A) N2O4的转化率越高
(B) NO2的产量越大
(C) N2O4与NO2的浓度之比越大
(D) 正反应进行的程度越大
 (5)要增大该反应的K值,可采取的措施
(5)要增大该反应的K值,可采取的措施
(A) 增大N2O4起始浓度
(B) 向混合气中通入NO2
(C) 使用高效催化剂
(D) 升高温度
(6)如图是80℃时容器中N2O4浓度的变化
图,请在该图中补画出该反应在60℃反
应时N2O4浓度的变化曲线。
19.有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:

请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,工业上保存A的方法为___________________________________________________________。
(2)写出下列化学用语:
用电子式表示乙分子的形成过程__________________________________________,
戊分子的结构式是______________,甲和丙反应产物的电子式 _______________。
(3)写出下列反应的化学方程式:
丙+丁→D + 乙:_____________________________________________
A+丙→D + 甲:_____________________________________________
18.已知a、b、c、d、e分别是Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种物质水溶液中的各一种。它们互相反应的情况如下表所示
|
|
a |
b |
c |
d |
e |
|
c |
↓ |
↓ |
╱ |
↑ |
- |
|
b |
↓ |
╱ |
↓ |
- |
- |
“↓”表示生成沉淀;“↑”表示产生气体;“-”表示无明显现象;“╱”表示实验未做。
则c 是 e是 (均填化学式)
17.铝和氢氧化钾都是重要的工业产品。请回答: (1)铝与四氧化三铁发生铝热反应的化学方程式为
(2)铝与氢氧化钾溶液反应的离子方程式是
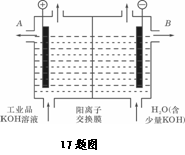 (3)工业品氢氧化钾的溶液中含有某些含氧酸盐杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
(3)工业品氢氧化钾的溶液中含有某些含氧酸盐杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是
____________________________
②通电开始后,阴极附近溶液pH会增大,其主要原因是 (填序号)
A.阳极区的OH-移向阴极所致
B.阴极产生的金属钾与水反应生成了大量OH-
C.阴极由H2O电离出的H+放电成H2,水电离平衡移动使OH-浓度增大
③除去杂质后的氢氧化钾溶液从溶液出口_____________(填写“A”或“B”)导出。
16. 1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向混合溶液中滴加某溶液
Z(0.1mol·L-1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )
 A、氯化铝、氯化铁、氢氧化钠
A、氯化铝、氯化铁、氢氧化钠
B、氯化铝、氯化镁、氢氧化钠
C、偏铝酸钠、氢氧化钡、硫酸
D、偏铝酸钠、氯化钡、硫酸
江苏省淮州中学2009届高三第一次月考
请同学们把1-16答案填入下表:
第Ⅱ卷(非选择题,共64分)
15.关于下列各装置图的叙述中,不正确的是 ( )
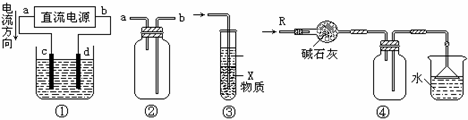
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com