
题目列表(包括答案和解析)
8.有关氧化还原反应实质的说法正确的是
A、是否有元素的电子转移 B、是否有元素的化合价变化
C、是否有氧元素参加 D、是否有原子重新组合
7.已知2FeCl3+2KI=2FeCl2+2KCl+I2,H2S+I2=2HI+S,下列叙述正确的是
A、氧化性Fe3+>I2>S B、氧化性I2>S>Fe3+
C、还原性Fe2+>I->H2S D、还原性Fe2+>H2S>I-
6.(原创)xR2++yH++O2 mR3++nH2O中,对m和R2+、R3+判断正确的是
A、m=4,R2+是氧化剂 B、2m=y,R3+是氧化剂
C、m=4,R2+是还原剂 D、m=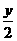 ,R3+是还原剂
,R3+是还原剂
5.在KClO3+6HCl=KCl+3Cl2+3H2O中,被氧化与被还原的氯原子个数比为
A、1:6 B、6:1 C、1:5 D、5:1
4.下列除去杂质的实验方法正确的是
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3中少量NaHCO3:置于坩埚中加热
C. 除去N2中少量NH3,可依次通过水、浓H2SO4洗后收集气体
D. 可用铁粉除去FeCl3溶液中的少量的CuCl2
3.某学生欲称取5.5 g食盐晶体,但在操作时将食盐晶体与砝码的位置放颠倒了,则实际称得的食盐晶体的质量为(1 g以下用游码) ( )
A.6.5 g B.6.0 g C.5.5 g D.4.5 g
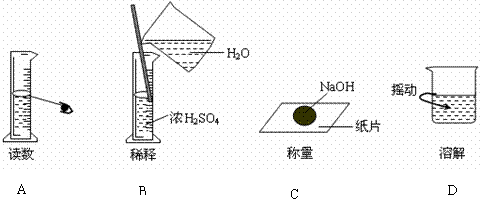
2.下图分别表示四种操作,其中有两个错误的是 ( )
1.用某种仪器测量某一溶液的体积时,平视读数为n mL,仰视读数为x mL,俯视读数为y mL。若x > n > y ,则使用的仪器可能是( )
A.烧杯 B.酸式滴定管 C.量筒 D.容量瓶
34.(10分) 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色黑体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
 [实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:
。
[实验二]向实验一的锥形瓶里滴加1 mol·L-1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:
。
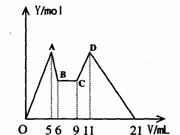
[实验三]取实验二的锥形瓶里的溶液10mL,向其中滴加a mLC1mol·L-1NaOH之后,改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)图中CD段消耗盐酸的体积是AB段消耗的NaOH溶液体积的两倍,则C1/C2= ;
(2)所加入NaOH溶液的体积a= mL。
高三第一次月考
33.( 8分)物质间的转化关系如下图所示:
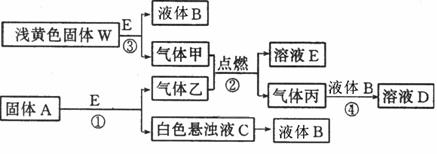
(1)写出反应③的化学方程式 .生成标准状况下5.6 L气体甲,则转移电子的物质的量为 mol。
(2)固体A是一种重要的工业原料。1 mol气体乙完全燃烧时生成l mol E和2 mol丙。则乙的电子式为
(3)C溶液中的溶质和丙以物质的量之比1:2反应时.该反应的离子方程式为
(4)利用图中有关物质,实现C→B的转变。该物质为 (填写化学式)
(5)若甲和乙恰好完全反应.则A与W的物质的量之比为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com