
题目列表(包括答案和解析)
18.
(1) ;
(2)
(3) (4)
(5)
17.(1) ;
(2)①
②
23.某结晶水合物含有两种阳离子和一种阴离子。现称取10.00g的该结晶水合
物,配制溶液。向其中加入足量的稀Ba(OH)2溶液,有浅蓝色沉淀生成;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;将所得气体用100.0mL0.5000mol/L硫酸吸收,多余的硫酸用2.000mol/LNaOH溶液滴定,用去NaOH溶液25.00mL。用盐酸处理上述浅蓝色沉淀,经洗涤和干燥,得到白色固体11.65g。
⑴该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
⑵试通过计算确定该结晶水合物的化学式

|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
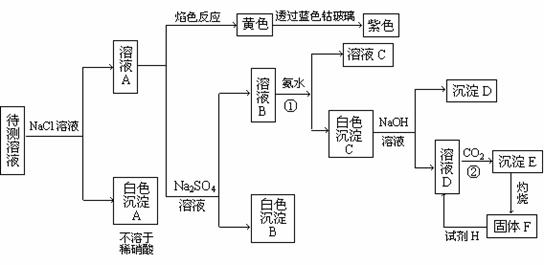
22. 100mL某无色透明溶液中可能含有Fe3+、Ag+、Al3+、Ba2+、Mg2+、K+、Na+等阳离子。进行下述实验(所加试剂均过量)
(1)根据下图推断:溶液中一定存在的阳离子除Al3+和Mg2+外还有 ;溶液中一定还大量存在阴离子,则其可能是 ;
(2)反应①、②的离子方程式分别为:
① 、 ;
② ;
(3)若实验中测得白色沉淀C和固体F的质量分别为13.6g和5.1g,则原溶液中Mg2+离子的物质的量浓度为 。
21.(10分)某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将0.454g X隔绝空气在1000℃以上强热,得到一种红色固体Y,质量为0.288g。Y溶于稀硫酸得到另一种红色固体0.128g和蓝色溶液。
(1)该实验人员认为沉淀X可能含有SO42-。他设计简单实验确定这一判断。操作如下:
① 将绿色沉淀过滤。
②
③
④用稀盐酸溶解绿色沉淀,并使溶液呈酸性,加入BaCl2溶液,白色沉淀生成,则说明沉淀X中有SO42-。
(2)Y与稀硫酸反应的离子方程式为: 。
(3)通过计算确定X的组成?
(4)混合时CuSO4和NaOH溶液的体积比为 ;写出X→Y的反应方程式::
。
20. 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,用双线桥标出电子转移的方向和数目:
______________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有______ ______(填化学式)。
①水样加入氢氧化铝悬浊液振荡过滤
②若水样中有可溶性硫化物,需加氢氧化钠调至弱碱性后,加入30%过氧化氢,有沉淀。
③若水样含高铁离子或铬酸盐,可加2mL新配制的对苯二酚溶液
④加入5-10滴混合指示剂,用0.025mol/LHg(NO3)2标准溶液滴淀水样,滴定至蓝紫色。
试回答下列问题:
(1)水样中加入氢氧化铝悬浊液的作用是: 。
(2)加入过氧化氢发生的离子反应为: 。
(3)加入对苯二酚的作用是: 。
(4)若滴定到终点时俯视滴定管读数,会导致水样中氯化物含量测定结果 (填“偏高”、“无影响”或“偏低”)。
(5)若用V1--水样消耗硝酸汞标准溶液的体积(mL),c--硝酸汞溶液浓度(mol/L),V--水样的体积(mL),则水样中氯离子的含量计算公式为:
氯化物中氯离子(Cl-,mg/L)= (用字母表示)。
19.过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。(填序号)

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4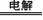 (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
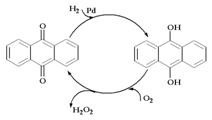
D.乙基蒽醌法:
(3).针对以下A-D四个涉及H2O2的反应(未配平),填写空白:
A.BaO2+HCl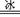 H2O2+BaCl2 B.Ag2O+H2O2=Ag+O2+H2O
H2O2+BaCl2 B.Ag2O+H2O2=Ag+O2+H2O
C.H2O2 H2O+O2↑ D.H2O2+NaCrO2+NaOH=Na2CrO4
+ H2O
H2O+O2↑ D.H2O2+NaCrO2+NaOH=Na2CrO4
+ H2O
(1)H2O2仅体现还原性的反应是(填代号)
(3)H2O2体现弱酸性的反应是(填代号)
(4)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
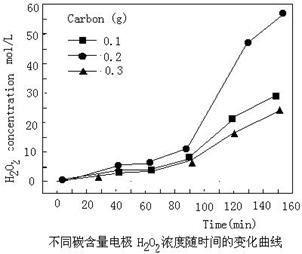
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(5)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚: 。
①配制氯化钠标准溶液和硝酸汞溶液,并用氯化钠标准溶液标定硝酸汞溶液
②配制氢氧化铝悬浊液、30%过氧化氢溶液及1%对苯二酚溶液等
①酸化的水样以硝酸汞[Hg(NO3)2]进行滴定时,生成难电离的氯化汞,滴定到终点时,过量的汞离子与指示剂二苯卡巴腙生成紫色的二苯卡巴腙的汞络合物指示终点。
②饮用水中各种物质在通常的浓度下滴定时不发生干扰,但水的色质及高价铁、六价铬、硫化物对实验有干扰。
18.国家环保总局于2007年5月1日起试行水质中氯化物的含量用硝酸汞滴定法,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com