
题目列表(包括答案和解析)
4.U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可
发生如下分解:UO2(NO3)2→UxOy+NO2↑+O2↑,在600K时,将气体产物集于试管并倒扣水中,水充满试管。则生成的铀的氧化物化学式是( )
A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
3.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3。则下列说法错误的是
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0 mol NO,转移的电子数目为6.02×1023
2.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述正确的是( )
A.PH3是极性键构成的非极性分子 B.PH3分子中存在未成键的电子对
C.PH3是一种强氧化剂 D.PH3比NH3更稳定
1.化合物X、Y在一定条件下发生下反应:X+Y→Z+H2O 。若Z是一种单质,则Z可能是( )
A.Fe B.C C.N2 D.F2
31.氮和磷
14.(17分)二氧化硫是污染大气形成酸雨的主要有害物质之一,如果了解二氧化硫的性质,它在
我们的生活中也有广泛的用途。
(1)下列可产生二氧化硫污染大气的是 。(填序号)。
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
|
测试时间段 |
0 |
1 |
2 |
3 |
4 |
|
雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析雨水样品PH变化的原因(用文字和化学方程式说明)
。
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告。
|
序号 |
二氧化硫的性质 |
主要操作和现象 |
化学方程式 |
|
① |
氧化性 |
将二氧化硫通入氢硫酸溶液中,溶液中出现浅黄色沉淀 |
2H2S+SO2=3S↓+2H2O |
|
② |
|
将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
|
|
③ |
|
 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 |
|
(4)目前,我国大都使用以亚硫酸类化合物为主的漂白剂,通过产生的二氧化硫而使食品漂白。我国《食品添加使用卫生标准》规定:“亚硫酸用于蜜饯、葡萄糖中的残留量(以二氧化硫计)不超过0.05 g/kg”。目前通常采用滴定法测定食品中残留二氧化硫的含量。具体实验方法主要是:样品经处理后,加入氢氧化钾使残留的二氧化硫以亚硫酸盐的形式固定,再加入硫酸使二氧化硫游离,用碘标准溶液滴定二氧化硫。在滴定时用 (填名称)作指示剂,滴定终点的现象是 。
(5)现有100 g二氧化硫含量超标的蜜饯样品经过处理后,配制成1000mL溶液,取出50 mL溶液,分别与氢氧化钾、硫酸反应,再用碘标准溶液 5×103mol/L滴定,消耗碘标准溶液5 mL,则样品中二氧化硫的含量(g/kg)为 (保留二位小数)。
13.(15分)物质A、B、C、D等的转化关系如图所示。已知A是由两种元素组成的化合物,B是常见的气态单质,J是常见的金属单质,反应①是工业上制取K的第一步反应,反应②为化合反应。
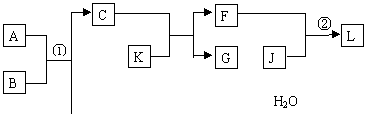

|
|
|


依据以上的信息,回答下列问题:
(1)B在元素周期表中的位置是 。
(2)F的水溶液显 (填“酸”、“碱”或“中”)性,用相关离子方程式表示
。
(3)反应①的化学方程式为 ,
工业上反应①在 (填工业设备)中进行。
(4)反应②的离子方程式为 。
12.(16分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致。则使溶液呈黄色的物质是 (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,则使溶液呈黄色的物质是 ,反应的离子方程式是 。
(2)你认为哪位同学的观点正确? (填“甲”或“乙”),为了验证你的判断的正确性,请选用下面提供的试剂,设计合理、简单的实验方案加以验证,请将选用的试剂代号及实验中观察到的现象填入下表(可不填满表格)。
实验可选用的试剂:
A.酸性高锰酸钾溶液 B.四氯化碳 C.硫氰化钾溶液
D.硝酸银溶液 E.碘化钾淀粉溶液
|
实验方案 |
选用试剂(填代号) |
实验现象 |
|
方案一 |
|
|
|
方案二 |
|
|
|
方案三 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是 ,
对应的离子方程式是 。
(4)若向100.0mL溴化亚铁溶液中通入0.012mol的氯气时,有70%的溴被氧化,则原溴化亚铁溶液的物质的量浓度为 。
11.(11分)现有五种离子化合物A、B、C、D、E都是由下列离子构成的:
阳离子:Ba2+、Al3+、Ag+;阴离子:OH-、Cl-、SO42-
分别具有如下性质:
①A溶于水后与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
②A溶液与适量的E溶液反应生成沉淀,再加入过量的E溶液沉淀量减少但不消失;
③B和D都不溶于水,也不溶于酸;
④C溶于水后与上述某阳离子反应可生成D,且C溶液与过量氨水反应可生成白色沉淀;
⑤E溶于水后与上述某阴离子反应可生成B。
根据上述性质推断:
(1)A的化学式: ;E的化学式: ;
D的名称: 。
(2)写出C溶液与过量的E溶液反应的离子方程式: 。
(3)A溶液与过量的E溶液反应最终得到沉淀的化学式: 。
10.一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L
(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1,则下列叙述中错误的是 A.气体A为SO2和H2的混合物
B.气体A中SO2与H2的体积之比为4:1 C.反应中共消耗97.5g Zn
D.反应中共转移3 mol电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com