
题目列表(包括答案和解析)
1.硝酸是一种重要的工业原料,下列关于硝酸的说法中正确的是( )
A.硝酸见光易分解,应保存在棕色试剂瓶中 B.常温下,Al、Fe不能与浓硝酸反应
C.硝酸能发生硝化、磺化、酯化反应 D.王水体积比3∶1的将浓硝酸和浓盐酸的混合物
33.硝酸
10.X、Y、Z为三种元素核电荷数依次增大,且X、Y、Z的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y原子最外电子层上的电子数是其电子层数的2倍,Z元素是植物生长的重要营养元素。请回答下列问题:
(1)写出Z的名称 。
(2)Y元素的单质中有一种称为足球烯的分子Y60,它可能最易发生的反应是 。
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)Z与X可形成多种化合物,其中Z2X4的电子式 ,Z2X4还可以以配位键与X结合得到结构很稳定的粒子,请写出该反应的离子方程式________________。
(4)Z的最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。丙对水的电离起 作用(填“抑制”、“促进”),丙中离子浓度大小顺序为 。
 (5)若X的燃烧热为M kJ·mol-1,试写出该反应的热化学方程式:
。
11.实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液与NH4Cl饱和溶液共热制取氮气:NaNO2+NH4Cl=NaCl
+ NH4NO2 ,NH4NO2 N2↑+2H2O。制取装置如图32-4所示:
(5)若X的燃烧热为M kJ·mol-1,试写出该反应的热化学方程式:
。
11.实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液与NH4Cl饱和溶液共热制取氮气:NaNO2+NH4Cl=NaCl
+ NH4NO2 ,NH4NO2 N2↑+2H2O。制取装置如图32-4所示:
|
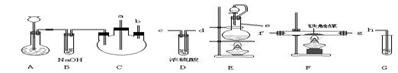
(1)装置A用于制取_____________________
(2)装置E中分液漏斗上方常用导管与圆底烧瓶相通,作用是_________。
(3)装置E与装置C直接相连,连接时导管口连接方法为e接____。装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口___接__ ,__ 接____,___接_____。
(4)装置D的作用为_________ 。装置F导出的气体的成分为_____________。
 (5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下_____(填“能”或“不能”),理由是_________________。
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下_____(填“能”或“不能”),理由是_________________。
|
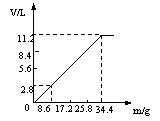
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标准状况)为____________L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标准状况)为___________L。
9.A、B、C、D、E、F、G是中学里常遇到的一些物质,它们之间有如下转化关系,有些必要的信息已在框图中注明:

回答下列问题:
(1)D的空间构型为 ,C的电子式为______________F溶液名称是____________
(2)在实验室中制取气体A的离子方程式是 .
(3)写出A+D→C的化学方程式 ,氧化剂与还原剂物质的量之比为____
(4)写出:F+B→E的离子方程式___________________________________________。
8.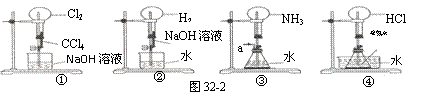 图32-2是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
图32-2是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
7.从某些性质看(CN)2和Cl2,NH3和H2O,NH4+和H3O+,NH2-和OH-各组内两两相似,据此判断下列反应其中正确的是( )
①(CN)2+2OH-=OCN-+CN-+H2O ②2Na+2NH3=2NaNH2+H2↑
③CuO+2NH4Cl=CuCl2+2NH3+H2O ④NH4Cl+NaNH2=2NH3↑+NaCl
A.①② B.③④ C.①④ D.都正确
6.一定条件下:4NH3+3F2 == NF3+3NH4F 下列说法中,正确的是( )
A.氧化产物与还原产物的物质的量之比为1∶3 B.NF3的还原性比NH3强
C.NH3的每个原子最外层都是8电子稳定结构 D.NH4F不稳定,受热易分解
5.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如图32-1
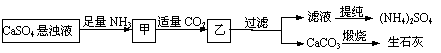
|
下列推断不合理的是 ( )
A.直接蒸干滤液得到纯净的(NH4)2SO4 B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用 D.往甲中通CO2有利于(NH4)2SO4生成
4.已知,C2H5NH2的化学性质与NH3相似,硝酸乙基铵((C2H5NH3)NO3)是一种盐,熔点为12℃。下列有关硝酸乙基铵的说法错误的是( )
A.常温下硝酸乙基铵可以做溶剂 B.硝酸乙基铵水溶液呈碱性
C.常温下硝酸乙基铵可以作为原电池的电解质 D.硝酸乙基铵是强酸弱碱盐
3.在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为( )
A.(2b-c)/a B.(2b-c)/2a C.(2b-c)/3a D.(2b-c)/6a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com