
题目列表(包括答案和解析)
3.(广东)设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
2.(江苏)用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
1. (山东)NA 代表阿伏加德罗常数,下列叙述错误的是( )
A. 10 mL 质量分数为 98 %的 H2SO4 ,用水稀释至 100 mL , H2SO4 的质量分数为 9.8 % B. 在 H2O2 + Cl2 = 2HCl + O2 反应中,每生成 32g氧气,则转移 2 NA 个电子
C .标准状况下,分子数为NA的 CO 、C2H4 混合气体体积约为 22 . 4L ,质量为 28g
D .一定温度下, 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含NH4+ 物质的量不同
20.某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜的质量分数为x,试回答下列。
(1)所得硫酸铜晶体的质量y为: g(用x表示);(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到 CuSO4·5H2O,试求原混酸中H2SO4的质量分数。
19.(2005年高考全国理综卷I,8分)
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
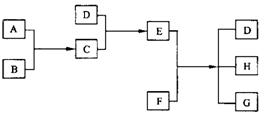
(1)D的化学(分子式)是 ,E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是 。
(3)E和F反应生成D、H和G的化学方程式是 。
18.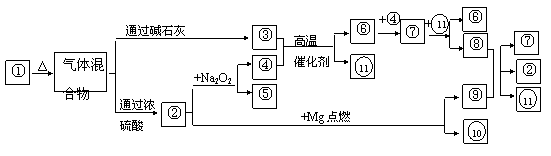
 (8分)下图①- 分别代表有关反应中的一种物质,请填写以下空白:
(8分)下图①- 分别代表有关反应中的一种物质,请填写以下空白:
⑴①、③、④的化学式分别是 、 、 ;
⑵⑧与⑨反应的化学方程式 。
17.(04年天津理综,10分)
I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途
。
II. 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。

[实验操作]① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
16.(04年北京理综,10分)资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
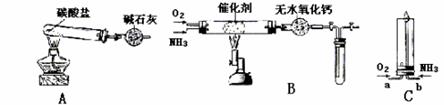
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该反应的化学方程式是 ;
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 。
其理由是
②氨气燃烧的化学方程式是 。
15.从某些性质看(CN)2和Cl2、NH3和H2O、NH4+和H3O+、NH2-和OH-各组两两相似。据此判断下列化学方程式或离子方程式正确的是 ( )
A.(CN)2+2OH-==OCN-+CN-+H2O B.2Na+2NH3==2NaNH2+H2↑
C.CuO+2NH4Cl==CuCl2+2NH3↑+H2O D.NH4Cl+NaNH2==2NH3↑+NaCl
第II卷(非选择题48分)
14.(2002年上海高考题)0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是 ( )
A.30 B.46 C.50 D.66
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com