
题目列表(包括答案和解析)
4.现有碳酸钠、碳酸氢钠、氢氧化钠、氯化铁和苯酚五种物质的溶液,它们之间有如图所示转化关系,图中每条线两端的物质可以发生反应,下列判断不合理的是
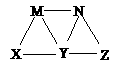 A.X一定是碳酸钠溶液
A.X一定是碳酸钠溶液
B.Y一定是氯化铁溶液
C.Z可能为碳酸氢钠溶液
D.M、N必定各为苯酚、氢氧化钠溶液中的某一种
3.美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.原子半径:Na>Al
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al) ≤ n(Na)
C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
2.用一定量的铁与足量的CuO制单质铜,有人设计了以下两种方案:
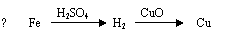
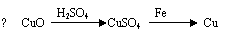
若按实验原则进行操作,则两者制得单质铜的量为
A.一样多 B.①多 C.②多 D.无法判断
1.下列金属冶炼的反应原理,错误的是
|
A.2NaCl(熔融) === 2Na + Cl2↑
|
|
C.Fe3O4 + 4CO === 3Fe + 4CO2 D.2CuO === 2Cu + O2↑
14.用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸溜水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。
(2)除去蒸馏水中溶解的O2常采用____ ____的方法。
 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__
。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__
。
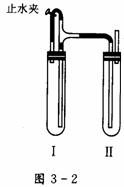
方法二:在如图3-2装置中,用NaOH溶液、铁屑、稀NaSO4等试剂制备。
(1)在试管I里加入的试剂是____ ____。
(2)在试管Ⅱ里加入的试剂是________。
(3)为了制得白色Fe(OH)2沉淀,在试管工和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________
13. 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
 请回答该实验中的问题。
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)酒精灯和酒精喷灯点燃的顺序是 ,为什么? 。
(5)干燥管中盛装是的物质是 ,作用是 。
(6)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。这一操作的目的是 。
12.(16分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:①NH3+CO2+H2O=NH4HCO3…②NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl…
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因 ______________
。
(2)现有甲、乙、丙三个小组学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
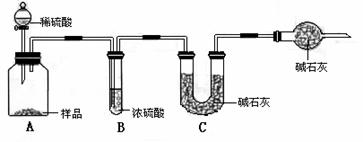 甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
乙组:取10.00g样品,配成1000mL
溶液,用碱式滴定管量取25.00mL放
入锥形瓶中,加入甲基橙作指示剂,
用0.150mol·L-1的标准盐酸溶液滴定
至终点(有关反应为Na2CO3+2HCl
=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至
所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
|
分析与 计算 分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
-------- |
|
丙组 |
|
成功 |
-------- |
附加题
11.(12分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.200g。把加热后残留的固体与足量稀硫酸充分反应,生成的气体充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084g。试回答:
(1)混合物中酸式碳酸盐有
 (不用写计算过程)。
(不用写计算过程)。
(2)加热灼烧后残留的固体含碳酸盐
 (不用写计算过程)。
(不用写计算过程)。
(3)通过计算确定两种盐的化学式,写出计算和推理过程。
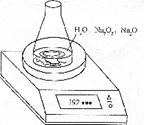
10.(16分)某种含有少量氧化纳的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用下图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式 。(2)计算过氧化钠质量分数时,必需的数据是 。不必做第6次读数的原因是 。
(3)测定上述样品(1.560g)中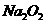 质量分数的另一种方案,其操作流程如下:
质量分数的另一种方案,其操作流程如下:
|
操 作 Ⅰ → 溶液转移 → 操作Ⅱ → 称量
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)。④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)
9.此题包括两小题Ⅰ(8分)下图中A至F是化合物,G是单质.写出A、B、E、F的化学式A _____ B _____ E ______ F ____

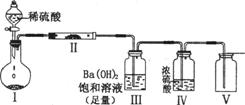 Ⅱ(8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
Ⅱ(8分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。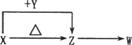 请回答:
请回答:
(1)X与Y在溶液中反应的离子方程式是 。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物利用上图装置(夹持固定装置己略去)进行实验,装置Ⅲ中生成白色沉淀,装置V中可收集到一种无色气体。
装置I中反应的化学方程式是 。
装置Ⅱ中反应的化学方程式是 。
装置Ⅲ中反应的化学方程式是 。
|
|
读数次数 |
质量/g |
|
锥形瓶 +水 +试样 |
第1次 |
192.214 |
|
第2次 |
192.164 |
|
|
第3次 |
192
028 |
|
|
第4次 |
192.010 |
|
|
第5次 |
192.010 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com