
题目列表(包括答案和解析)
6.为测定某一铁矿石样品中的铁元素的质量分数, 取3.702g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250mL,从中取出25mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁。有关实验数据:坩埚质量:15.2861g,第一次灼烧后坩埚和固体的质量:15.6209g 第二次灼烧后坩埚和固体的质量:15.6205g,第三次灼烧后坩埚和固体的质量:15.6205g 则铁矿石中的铁元素的质量分数为A.63.2% B.90.3% C.6.32% D.34.4%
4.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量不可能为6.4g B.生成沉淀完全时消耗NaOH溶液的体积为100mL
C. 参加反应的硝酸的物质的量为0.1mol D.溶解合金时收集到NO气体的体积为2.24L
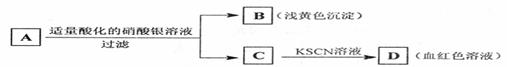 5.某学生设计了如下图中的方法对A盐进行鉴定:
5.某学生设计了如下图中的方法对A盐进行鉴定:
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+ C.B为AgI沉淀 D.A一定为FeBr2溶液
3.下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是①金属钠投入到FeCl3溶液②过量NaOH溶液和明矾溶液③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液 A.① B.③ C.②③ D.①③④
2.现有100 mL 溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是A.25mL B.5mL C.30mL D.100 mL
1. a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为 (A)1:7 (B)7:1 (C)7:8 (D)8:7
12.(14分)碱式碳酸镁有多种不同的组成,如:Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。某研究性学习小组同学为确定某种碱式碳酸镁的组成,设计下图所示的实验装置。
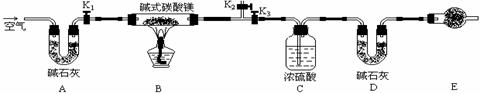
(1)实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作_____ 。
E处干燥管盛放的药品是_______ ,其作用是 。
②称取碱式碳酸镁样品m1g,并将其放入硬质玻璃管中;称量;装浓硫酸的洗气瓶C的质量为m2 g,装碱石灰的U型管D的质量为m3 g。
③打开活塞__________,关闭___________,缓缓鼓入空气数分钟。
④关闭活塞__________,打开___________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为m4 g;U型管D的质量为m5 g。实验测得数据如下:m1 =31g,m2=87.6g,m3=74.7g,m4 =89.4g,m5=87.9g,计算推导:该碱式碳酸镁的化学式为________________。
(2)关于该实验方案,以下说法你认为正确的是________________。(填字母)
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碳酸镁的组成
C.该实验装置也可用于确定天然碱[aNa2CO3.bNaHCO3.cH2O(a、b、c为正整数)]的化学组成
附加题:
11. I(6分)1L某混合溶液,可能含有的离子如下表:
I(6分)1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、ClO-、AlO |
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示。则该溶液中确定含有的离子是 ,一定不含有的阳离子是 ,一定不存在的阴离子是 。
 II(10分)将NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解.用1mol/L稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量的关系如图所示.
II(10分)将NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解.用1mol/L稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量的关系如图所示.
(1)A-B段所发生反应离子方程式是 ;
(2)D点所表示的沉淀的化学式是 ;
(3)B点所表示的沉淀的质量是 g;
(4)沉淀质量为10.1g时,通过计算求需加入稀硫酸的总体积是 毫升或 毫升。
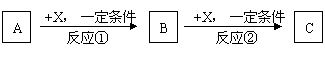
9.(14分) A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
试回答:
(1)若X是强氧化性单质,则A不可能是 。 a. S b. N2 c. Na d. C2H5OH e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的离子方程式和文字说明):_______ ______________________。检验此C溶液中金属元素价态的操作方法是:_____________________ _______________。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,则B的化学式为 ,X的化学式可能为(写出一种物质)__________________,反应①的离子方程式为 _____________________________。
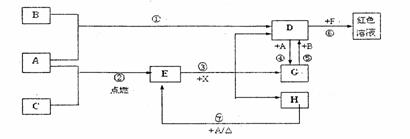 10.(16分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为红棕色液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
10.(16分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为红棕色液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式:D ;X 。
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。
(3)反应⑥的离子方程式为: 。
(4)往G溶液中加入NaOH溶液观察到的现象是 。
(5)反应⑦的化学方程式为 ;
该反应中每消耗0.3mol的A,可转移电子 mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为 。
8.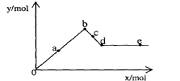 已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量
已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量
y与加人Ba(OH)2的物质的量x的关系.下列有关叙述正确的是
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量: BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
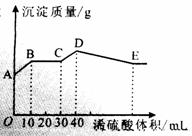
7.
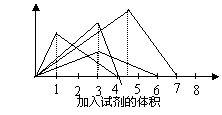 右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出没有对应的曲线变化关系的实验项
右图纵坐标表示沉淀的质量,横坐标表示所加试剂的体积,请选出没有对应的曲线变化关系的实验项
A.往NaOH溶液中逐滴加入AlCl3溶液
B.往澄清石灰水中逐渐通入CO2气体
C.往AlCl3溶液中逐滴加入NaOH溶液
D.往NaAlO2溶液中逐滴加入盐酸溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com