
题目列表(包括答案和解析)
10.单质铁溶于一定浓度的硝酸中反应的化学方程式如下:
a Fe+b NO3-+c H+==d Fe2++f Fe3++g NO↑+h N2O↑+k H2O(化学计量数均为正整数)
请你用已掌握的知识研究出下列规律。
(1)c、g、h的关系式是______________________________。
(2)b、c、d、f的关系式是_________________________________________。
(3)d、f、g、h的关系式是__________________________________________。
(4)若a =12,铁和硝酸恰好完全反应,则b的取值范围是____________。c的取值范围是____________________ __。
9.(1)选择下列实验方法分离物质,将分离方法的序号填在横线上:
A.过滤 B.结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
① 分离水和四氯化碳的混合物;
② 分离氯化钾溶液和沙子的混合物;
③ 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
④ 分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
⑤ 分离食盐和碘的混合物;
⑥ 从碘水中提取碘单质。
(2)将NO3-+Zn+0H-+H2O NH3+Zn(0H)42- 配平后,离子方程式中的系数是H2O的系数是
(3)完成下列离子方程式(给出物质的计量数不能改变)
① +6H+ = 2Fe3+ + 3
② +Ca2++2 =CaCO3↓+
(4)某反应池中,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示: NH4++ O2→ NO3- + H+ + H2O
①配平上面化学方程式,将系数填入方框中。
②将铵态氮中的1mg氮转化成硝酸根中的氮,需氧气_________毫克。
③3级反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示:
NO3-+5CH3OH→ N2+ CO2+ H2O+ OH-
配平上面化学方程式,将系数填入方框中。
8.下列情况下,离子组间一定能在溶液中同时大量共存的是
A.水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO3-、Cl-、SO42-
B.PH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+
C.CO32-可以大量存在的溶液:Ag+、K+、NO3-、Al3+
D.PH=2的溶液中:SO42-、K+、NO3-、Al3+
7.反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2 (1)
2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2 (2)
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物 B.I2在反应(1)是还原产物,在反应(2)中是氧化产物 C.氧化性:MnO2>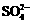 >
>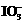 >I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1∶5
>I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1∶5
5.有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.OH-、S2-、CO32- B.MnO4-、SO42-、NO3- C.Cl-、NO3-、SO42- D.AlO2-、MnO4-、SO42-
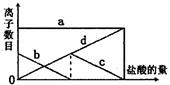 6.向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
6.向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是
A.a:Cl-;b:K+;c:CO32-;d:HCO3-
B.a:K+;b:CO32-;c:Cl-;d:HCO3-
C.a:K+;b:CO32-;c:HCO3-;d:Cl-
D.a:K+;b:HCO3-;c:Cl-;d: CO32-
4.下列各组混合物的分离和提纯方法不正确的是 A.用蒸馏法分离乙醇和苯酚的混合物 B.用加热法分离碘和氯化铵的混合物
C.用结晶法提纯NaCl和KNO3混合物中的KNO3
D.用渗析法分离Fe(OH)3胶体和FeCl3溶液的混合物
3.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将:FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5-36 nm的磁流体。下列说法中,正确的是 A.所得的分散系属于溶液 B.所得的分散系中分散质为Fe2O3
C.当一束强可见光通过该分散系会出现光亮的通路 D.该分散系不属于介稳体系
2.列离子方程式错误的是
A.Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++ =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
B.向10mL 1.5mol·L-1NaHSO4溶液中加入10mL 1mol·L-1Ba(OH)2溶液:
H++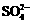 +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
C.工业用石灰乳制漂白粉:Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O
D.向20mL沸水中滴入1mL饱和FeCl3溶液,继续煮沸至溶液呈红褐色:
Fe3++3H2O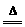 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
1.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤下列操作顺序不合理的是A.③②①⑤④ B.③①② ⑤④ C.②③① ⑤④ D.①③② ④ ⑤
7.下图表示各物质之间的相互转化关系(部分反应物或生成物未列出)。其中A、D为常见金属,J为红褐色沉淀。

(1)A的原子结构示意图为_____________,B的化学式为_______________。
(2)反应②的离子方程式________________________________________,反应⑥的化学
方程式___________________________________________________________。
(3)在反应③中,要使E中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物
是________;若将E溶于过量盐酸,反应的离子方程式为___________________。
(4)在实验室进行反应⑧时,观察到的现象是__________________________________,
在所得产物中加入水,得浑浊液,要使其变澄清,可加入少量的_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com