
题目列表(包括答案和解析)
8.U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解。UO2(NO3)2→UxOy+NO2↑+O2↑,在600K时,将气体产物集于试管并倒扣水中,水充满试管。则生成的铀的氧化物化学式是A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
7.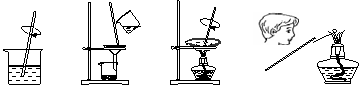 由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的是
由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的是
A.溶解 B.过滤 C.蒸发 D.焰色反应
6.溶质质量分数为98%的浓硫酸(ρ=1.84g/mL),其物质的量浓度为18.4mol/L,取10mL该硫酸与amL水混合,配制成溶质质量分数为49%的硫酸(ρ=1.40g/mL),其物质的量浓度为bmol/L,则a、b分别为( )
A. a>10 b<9.2 B. a<10 b>9.2 C. a=10 b=9.2 D. a>10 b=9.2
5.下列各组物质间反应可能包括多步反应 , 其总的离子方程式正确的是 :
A. NaClO 溶液 中通入过量 SO2: C1O-+ SO2 + H2O= HClO +HSO3-
B. FeCl2在空气中被氧化: 4Fe2++O2+2H2O=4Fe3++4OH-
C. A1Cl3溶液中投入过量Na: A13++4Na+2H2O = A1O2-+ 4Na++ 2H2 ↑
D. FeBr2溶液中通入少量C12: 2Fe2++4Br-+3C12= 2Fe3++2Br2+6C1-
4.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3; ② 还原性:Cl->As; ③ 每生成7.5gAs,还原剂失去的电子为0.3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
3.下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是:①碳酸钠溶液与盐酸;②偏铝酸钠溶液与盐酸;③苯酚钠溶液和CO2;④硝酸银溶液和氨水;⑤氯化铝溶液与氨水;⑥碳酸氢钠溶液与澄清的石灰水。
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
2.设NA表示阿伏加德罗常数,下列说法中不正确的是
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
C.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
D.125gCuSO4·5H2O晶体中含有0.5NA个S原子
1. 现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示,据此,将甲和乙互相分离的方法是A.萃取法 B.升华法 C.蒸馏法
D.过滤法
现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表所示,据此,将甲和乙互相分离的方法是A.萃取法 B.升华法 C.蒸馏法
D.过滤法
12.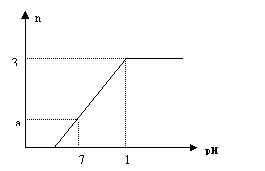 向盛有VLNaHSO4和Na2SO4混合溶液的烧杯中不断加
向盛有VLNaHSO4和Na2SO4混合溶液的烧杯中不断加
入Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为
2VL。溶液中产生沉淀的物质的量与溶液的pH变化如图。求
原溶液中NaHSO4、Na2SO4 及所加Ba(OH)2三者的物质
的量浓度。
(1) c(NaHSO4)__________________(2)c(Na2SO4)___ __________
(3)c(Ba(OH)2)__________________
附加题
11.将标准状况下15.68L的氯气通入70℃的500mL氢氧化钠溶液中,其氧化产物为次氯酸钠和氯酸钠(假设反应过程中溶液的体积不变)。取一定量溶液用醋酸酸化后,加入过量的碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾,用浓度为0.20mol·L-1的硫代硫酸钠溶液滴定析出的碘,其反应的离子方程式为:I2+2S2O32-==S4O62-+2I-,消耗硫代硫酸钠溶液5.00mL恰好至终点。将滴定后的溶液用盐酸调至强酸性,此时只发生氯酸钠氧化碘化钾的反应,析出的碘用上述硫代硫酸钠溶液再滴定至终点,需要硫代硫酸钠溶液30.00mL。
(1)写出在酸性溶液中,氯酸钠氧化碘化钾的离子反应式(提示:ClO3-→Cl-)
;
(2)计算反应后溶液中次氯酸钠和氯化钠的物质的量之比为 ;
(3)计算反应后溶液中次氯酸钠和氯化钠的物质的量浓度分别为 ; ;
(4)写出氯气通入70℃的500mL氢氧化钠溶液中的总反应的方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com