

题目列表(包括答案和解析)
17、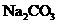 Ba(OH)2
Ba(OH)2 
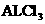
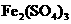 (每空2分)
(每空2分)
20.(12分)(1)N2(g)+3H2(g)  2NH3 (g) △H=-92kJ·mol-1(2分)
2NH3 (g) △H=-92kJ·mol-1(2分)
(2)-221 kJ·mol-1 (3分)
(3)①键能越大,物质的热稳定性越强(2分) ②185(3分)
③不赞同,H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S是因为水分子间存在氢键,与键能无关(2分)
6、(7分)在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出。化学式中OH为氢氧根,而M、A、D、E代表四种未知元素。已知⑴X+Y+Z=12(x、Y、Z为正整数)。⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g。⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2-3滴在白色点滴板(或玻璃片)上,再滴加1-2滴硫氰化钾溶液,溶液呈血红色。⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g。⑸化合物中A元素的百分含量为34.64%。试通过计算推理判断:
⑴ 确定D和E: 、 (写元素符号)。
⑵ 确定x、y、z和A: x==_______、y==_______、z==_______、A是_____________。
⑶ 化合物的化学式为____________________。
B B D D B , A D A D C , D C C B C
5、(10分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和Cu SO4, 在空气中加热生成CuO
提出假设
假设l:红色粉末是Fe2 O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若假设1成立,则实验现象是
(2)若假设2成立,则实验现象是有
(3)若固体放入足量稀硫酸中,经充分反应后,固体全部溶解,滴加KSCN试剂时,溶液
不变红色,则证明假设 (填数字)成立,写出可能发生的离子方程式
(4)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲用加热法测定Cu2O
的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
4、(8分)高温下,向1mol灼热的Cu2S中通入足量的水蒸气,生成2mol氢气,同时生成金属铜和一种有刺激性气味的气体。
(1)写出该反应的化学反应方程式________________________________________
(2)该反应中被氧化的元素是_________________,被还原的元素是__________
(3)每生成1molH2,氧化剂与还原剂之间转移的电子的物质的量是________mol.
3、(10分)A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ AI3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- 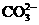 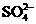 HCO3- HCO3- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别其他四种溶液反应,均有沉淀;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是A ;B ;C ;D ;E 。
2、(10分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (“偏高”或“偏低”)
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (“偏高”或“偏低”)
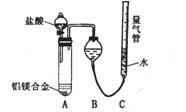 [探究二]实验方案:铝镁合金
测定生成气体的体积,实验装置如右图,
[探究二]实验方案:铝镁合金
测定生成气体的体积,实验装置如右图,
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间
添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
 ①
②
①
②
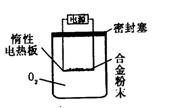
[探究三]实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热
板上,通电使其充分灼烧。
问题讨论:(1)欲计算Mg的质量分数,该实验中还需测定的数据是
(2)若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
[实验拓展] 参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。(书写形式可以模仿探究一、二)
15、氯酸是一种强酸,室温下,浓度超过40%时就会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A.由反应可确定:氧化性HClO4>HClO3
B .若化学计量数a=8,b=3,则该反应转移电子数为18e-
C .变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
D.若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示为
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
14、向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出0.06 mol NO,往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的原混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com