
题目列表(包括答案和解析)
4.下列实验能达到预期目的的是
A.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl2饱和溶液制备Fe(OH)3胶体
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.称取19.0 g SnCl2,用100 mL蒸馏水溶解,配制1.0 mol·L-1 SnCl2溶液
D.用氢氧化铜粉末检测尿糖.
3. 下列描述中,符合化学科学的是
A、“曾青得铁则化为铜”中的“曾青”是指硝酸铜
B、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C、“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
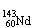
|
|
|
|
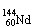
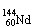
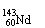 A、 和 互为同素异形体;
B、元素Nd是主族元素
A、 和 互为同素异形体;
B、元素Nd是主族元素
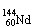 C、 和 中中子数和质子数均不相同;
C、 和 中中子数和质子数均不相同;
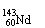 D、因各地岩石中 和 含量不同,所以Nd元素没有固定的相对原子质量
D、因各地岩石中 和 含量不同,所以Nd元素没有固定的相对原子质量
2.合成氨工业中用铁触媒来催化N2和H2合成NH3 。若将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),则该b L气体中的NH3体积分数是
A.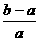 B.
B.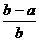 C.
C.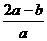 D.
D.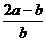
22.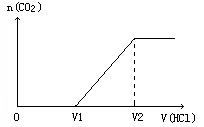 (12分)某学生为探究CO2与NaOH溶液的反应过程,进行了以下实验:
(12分)某学生为探究CO2与NaOH溶液的反应过程,进行了以下实验:
(1)在100mL 2mol/L的NaOH溶液中通入一定量的CO2
(2)在以上溶液中取出20mL,滴加一定浓度的盐酸溶液至过量。在滴加过程中产生气体的物质的量与加入盐酸体积的关系如右图,试讨论:
① 如V1/(V2-V1)=1,实验(1)中通入CO2的体积为____________________mL(标准状况)
② 如V1/(V2-V1)>1,实验(1)中通入CO2的体积为____________________mL(标准状况)
③ 如V1/(V2-V1)<1,实验(1)中通入CO2的体积为____________________mL(标准状况)
④ 如V2=40mL,加入盐酸溶液的浓度为_______________。
21.(8分)铁及其化合物之间的相互转化可用下式表示:
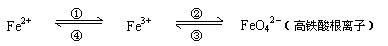
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)
则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3。高铁酸钾作为水处理剂发挥的作用是_______、_________。
20.(10分)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。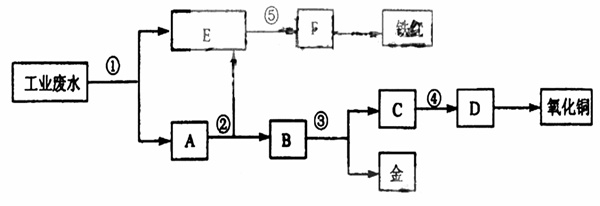
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ 。
(2)写出①处发生反应的离子方程式 。写出③处发生反应的化学方程式 。
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
19.(11分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体。该气体能使饱和石灰水变浑浊。
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色。
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由。
实验①____________________________________________________________。
实验②____________________________________________________________。
实验③____________________________________________________________。
实验④____________________________________________________________。
实验⑤____________________________________________________________。
(2)上述5个实验不能确定是否的离子是___________________。
18.(8分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1) 甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是
(2) 现提供以下试剂:A.酸性高锰酸钾溶液 B.稀硝酸 C.四氯化碳D.硫氰化钾溶液。请判断甲和乙中哪位同学的推断是正确的,并用合适的方法加以验证,写出选用的试剂(限上述提供的试剂)及实验中观察到的现象。 ;
(3) 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? ,
理由是:
17.在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+。则下列判断正确的是( )
A. 混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3
B. 反应后所得溶液中的Fe2+和Cl-的物质的量之比为1:3
C. 混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D. 混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
第II卷(非选择题:共49分)
16.下列中学常见实验的现象或表述正确的是:( )
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.向饱和FeCl3溶液中滴入少量NaOH溶液,煮沸后即得红棕色Fe(OH)3胶体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com