
题目列表(包括答案和解析)
24.(10分)
I .右图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴
加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (1分)(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)(2分)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)(1分)
|
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系
是 (1分)
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)(2分)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知
a+b=13 :
(5)该温度下水的离子积常数K w的数值为 。(1分)
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(2分)
23.(10分)
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。(1分)
 某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:(2分)
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸。请在方格中画出该装置:(2分)
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (1分)(填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (1分)
(填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗? (1分) (填“同意”或“不同意”),原因是 。(1分)
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:
(3分)。
22.(每空2分,共8分)
已知当溶液的pH在10左右时,铝元素主要以Al(OH)3形式存在。如果饮用水中含有
一定浓度的NO3-将对人体健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ)使其失去携氧功能:NO3-还能被水中还原性物质还原成具有强烈致癌作用的NO2-。为此世界卫生组织规定饮用水中NO3-含量(以N计)必须小于10mg·L-1。为降低饮用水中NO3-的浓度,某研究人员提出以下3种方案:
a. 微碱性条件下用Fe2+ 还原,还原产物为NH3。
b. pH=10.25时,用铝粉还原,NO3-的还原产物主要为N2。
c. 在催化剂作用下用氢气还原,还原产物主要为N2。
(1)a方案中的一种产物还有净水作用,这种物质是 。(请填写化学式)
(2)b方案中最好用 调节pH 。
A.NaOH B.CaO C.NH3·H2O
理由是 。
(3)与a、b方案相比,c方案的优点是 。
21. (12分)
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤
 进行:
进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)
操作II必须用到的仪器是 。(填编号) (每空1分)
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式 ,(1分)
加入氨水要过量的原因是 。(1分)
(3)检验沉淀是否已经洗涤干净的操作是 。(2分)
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是
。(2分)
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (2分)(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (1分)(写出一种原因即可)。
20.下列实验操作或事故处理的做法,其中正确的是
A. 用待测液润洗滴定用的锥形瓶
B. 配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
C. 用10mL的量筒量取4.80mL的浓硫酸
D. 不慎接触过多的氨,及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛
第Ⅱ卷 非选择题(共80分)
19.往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3
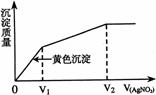 溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为
溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
18.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH-
和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>cOH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
17.利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。上述电池工作时,有关说法正确的是

A 铝罐将逐渐被腐蚀
B 碳粒和炭棒上发生的反应为:O2+4e-=2O2-
C 炭棒应与玩具电机的负极相连
D 该电池工作一段时间后炭棒和炭粒的质量会减轻
16.碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁
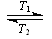
上的钨可以发生反应:W(s)+I2(g) WI2 (g) ,ΔH<0(温度T1<T2)。下列说法正确的是
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
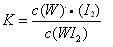
C.该反应的平衡常数表达式:
D.利用该反应原理可以提纯钨
15.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com