
题目列表(包括答案和解析)
3.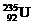 是重要的核工业原料,在自然界的丰度很低。
是重要的核工业原料,在自然界的丰度很低。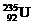 的浓缩一直为国际社会关注。下列有关说法正确的是
的浓缩一直为国际社会关注。下列有关说法正确的是
A.U元素的相对原子质量为235
B.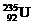 中质子数比中子数多51
中质子数比中子数多51
C.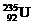 与
与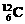 的物质的量比为12∶235 D.
的物质的量比为12∶235 D.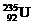 与
与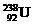 互为同位素
互为同位素
2.下列能达到实验目的的是
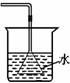
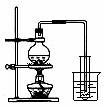
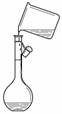
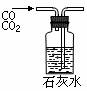
A.吸收氨气制氨水 B.制取少量蒸馏水 C.转移溶液 D.除去杂质气体CO2
1.从2006年1月1日起,江苏省徐州、连云港、淮安、盐城、宿迁等苏北五市已全面推广使用车用乙醇汽油。下列各说法中正确的是
A.乙醇汽油是纯净物,汽油是混合物
B.推广使用乙醇汽油是为了减少温室气体排放
C.推广使用乙醇汽油是为了减少化石燃料消耗
D.用粮食生产乙醇是开发新能源的发展方向
21.(10分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制
取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶
液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总
质量为480 g,其中铜单质的质量分数为x,试回答下列问题。
(1)所得硫酸铜晶体的质量y为: g(用x表示);
(2)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为: ;
(3)若x=0.4时,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到
CuSO4·5H2O,试求原混酸中H2SO4的质量分数(写出计算过程)。
镇江市2009届高三第一次调研测试
20.(10分)A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
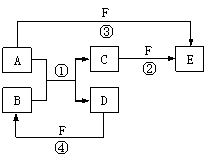
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是_________________________;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式_____________ __。
(2)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生, A、D相遇有白烟生成, 则C的电子式是________________,反应③的化学方程式是___________________ _____________________。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是_______________________________ __________。
19.(12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投
入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,
产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液
中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因
可能是___________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开
始阶段产生气体的速率不断加快的原因是
。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
负极 |
NaOH |
2Al-6e-+8OH-=2AlO2-+4H2O |
6H2O+6e-=6OH-+3H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Mg+2e-=Mg2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
其中正确的是__ __(填序号),由此推知,金属作电极不仅与本身性质相关,而且与__ __有关。
5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试
管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙 E.双氧水 F.硝酸银
18.(10分) X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢
化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
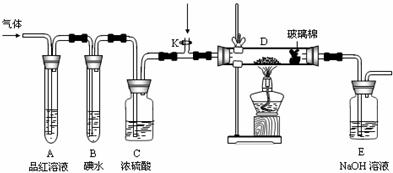
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不
相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为
;若装置D中装的是五氧化二钒,当通入足
量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了
17.(10分)几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_________________。
(3)A与J所形成的化合物的晶体类型是 。
(4)DB2的结构式 。
(5)过量的D的最高价氧化物与一定量的J的最高价氧化物对应水化物X的溶液发
生反应的离子方程式: 。
16.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e →NO + 2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: ;
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
____________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com