
题目列表(包括答案和解析)
2、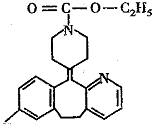 开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列有关说法正确的是( )
开瑞坦是治疗过敏性鼻炎的良药,其有效成分的结构简式如图所示,下列有关说法正确的是( )
A、该有机物的分子式是C22H23N2O2Cl
B、分子中含有四个六元环,其中有一个是苯环
C、1mol分子发生水解反应后能得到2mol新分子
|
1、磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,可用于潜水艇推进器等。制备某种磁流体时,将等物质的量的硫酸亚铁溶液和硫酸铁溶液混合,滴稍过量的氢氧化钠溶液,随后加入油酸钠溶液,所得磁流体的黑色粒子直径在5.5nm-36nm之间。下列说法正确的是( )
A、所得磁流体属于纯净物 B、油酸钠既含有亲水基又含有憎水基
C、油酸钠化学式为C17H35COONa D、所得磁流体的黑色粒子为氧化亚铁
21.(12分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法海水淡化最理想的能源是 ;
(2)从海水中可得到多种化工原料和产品。下列是利用海水资源的流程图。
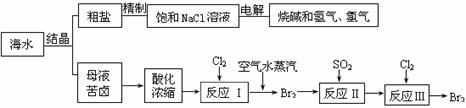
① 反应II的离子方程式为 ;
从反应III后的溶液中得到纯净的单质溴的实验操作方法是 。
② 在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ;
③ 电解25%的饱和食盐水200kg,当NaCl浓度下降到20%时,计算收集到氯气的物质的量。(溶于溶液的氯气忽略不计,计算结果保留一位小数)
海门市2009届高三第一次诊断性考试试卷
20.(10分)短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为____________;B和C形成的化合物电子式为___________;
(2)B和D简单离子的半径大小为________________;(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
①比较两种单质的颜色 ②比较氢化物的稳定性
③依据两元素在周期表的位置 ④比较原子半径大小
⑤比较最高价氧化物对应水合物的酸性
(4)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
19.(10分)已知NaBH4是一种强还原剂,其中B元素处于最高价态。解决下列问题:
(1)在60年代,德国拜尔药厂用下面的反应把NaBH4的生产发展成工业规模。请将下列反应方程式配平,各物质的计量数填入相应方格中:
ðNa2B4O7+ðNa+ðH2+ðSiO2=ðNaBH4+ðNa2SiO3
上述反应中发生氧化反应的物质有 ;
(2)NaBH4极易溶于水并与水反应产生H2,反应后硼以BO2-形式存在,且反应前后硼元素化合价不变,则NaBH4与水反应的离子方程式为_______________;
如果反应中转移2mol电子,则可生成标准状况下的H2为 L;
(3)在碱性条件下NaBH4不与水反应,可使许多金属离子还原成原子,反应后硼仍以BO2-形式存在。如在冶金工业中,常用NaBH4处理含Au3+的废液。如要处理800kg含Au 1.97%的废液,则理论上需NaBH4的质量___________g。
18.(10分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。


(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
|
①所有的离子方程式均可以表示一类反应 |
|
|
②酸碱中和反应均可表示为:H++OH-=H2O |
|
|
③离子方程式中凡是难溶性酸碱盐均要用“↓” |
|
17.(12分)加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
[问题1]工业生产碘酸钾的流程如下:
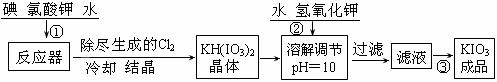
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式:_________________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是____________。
|
温度/℃ |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
[问题2]已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
I2+2S2O32―=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又进行了下列实验:
|
操作步骤 |
实验现象 |
|
取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
|
滴入5滴淀粉溶液和1mL
0.1mol/L KI溶液,振荡。 |
溶液无变化 |
|
然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
16.(12分)实验室常用的几种气体发生装置如图A、B、C所示:
|
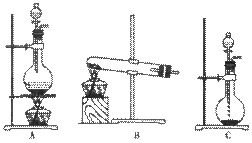
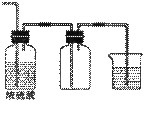
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。检查C装置气密性是否良好的操作方法是 。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是
(填序号,下同。)
① 密度 ② 颜色 ③ 溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是
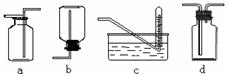
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______
①CO2 ② NO ③ Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________。
15.(6分)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F、配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大。
14.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时收集到NO气体的体积为2.24L
第二卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com