
题目列表(包括答案和解析)
22、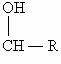
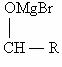
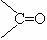 (14分)已知:①卤代烃可以和某些金属反应生成烃基金属有机化合物。后者又能与含羰基( )的化合物反应生成醇:
(14分)已知:①卤代烃可以和某些金属反应生成烃基金属有机化合物。后者又能与含羰基( )的化合物反应生成醇:
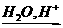
RBr+Mg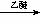 RMgBr
RMgBr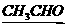 CH3-
CH3-
CH3-
CH3-
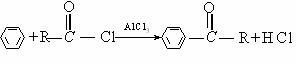
②苯在AlCl3催化下能与酰卤发生如下反应:
有机物E可由下述路线合成:
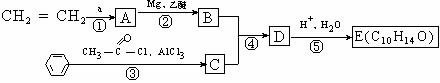
E与硫酸共热到适当温度可得到F和G。F分子中所有碳原子均可共处于同一平面上,而G却不能。回答下列问题:
(1)E、F、G的结构简式分别是:E_______,F________,G_________。
(2)写出下列化学反应方程式:
①__________________________________________________,
④__________________________________________________。
(3)E′是E的同分异构体且与E属同一类别。若E′不能从羰基化合物直接加氢还原得到,则E′可能的结构简式为__________;若E′能被催化氧化生成醛,且E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为_______________。
21、(12分)火力发电厂燃煤排烟,释放出大量的氮氧化物、二氧化硫和二氧化碳等气体。北京某热电厂同时具有烟气脱硝、脱硫、二氧化碳捕集(脱碳)设施,成为高效、节能、绿色环保燃煤电厂。请回答下列问题:
(1)脱硫方法
碳酸钙(CaCO3)作吸收剂与水配制成浆液,在吸收塔中洗涤烟气并吸收SO2,得到产品石膏(CaSO4·2H2O),生产流程是:SO2→H2SO3→CaSO3→CaSO4→CaSO4·2H2O,其中属于复分解反应的化学方程式是______________________;属于氧化还原反应的方程式是________________。
(2)脱碳方法:
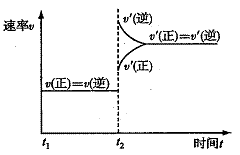 ①二氧化碳转化为甲醇,反应的化学方程式是
①二氧化碳转化为甲醇,反应的化学方程式是
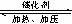 CO2+3H2
CH3OH+H2O,如图是改变
CO2+3H2
CH3OH+H2O,如图是改变
温度时化学反应速率随时间变化的示意图,则
反应的正反应方向是___________热(填“吸”
或“放”)反应。
②二氧化碳转化为其他能源物质,一定条件下,将1 L CO2与4 L H2混合,恰好完全反应生成某种烃,反应的化学方程式是___________________________________。
③烟气喷氨脱碳技术,喷淋氨水吸收过量的二氧化碳所得产物的名称是_________,该产物与过量的NaOH溶液共热产生的气体可循环使用,其离子反应方程式是____________________________。
(3)脱硝方法:
催化还原法,用CO(NH2)2(尿素)作还原剂,在加热条件下催化还原氮氧化物,1 mol CO(NH2)2反应时失去6mol电子,尿素与二氧化氮反应的化学方程式是_________
____________________________________________________。
20、(10分)(1)一透明溶液,已知其中可能含有Cu 、Fe
、Fe 、Al
、Al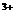 、NH
、NH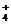 、HCO
、HCO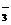 、K+、SO
、K+、SO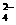 、Mg
、Mg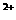 。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实现现象及数据判断:溶液中肯定有__________离子,肯定没有__________离子,可能有_________离子。
。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实现现象及数据判断:溶液中肯定有__________离子,肯定没有__________离子,可能有_________离子。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1g工业甲醇样品,以适量H2SO4酸化后,加入20mL 0.2mol/L的K2Cr2O7溶液,再用0.3mol/L(NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20mL时,刚好到达滴定终点。
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式:
________________________________________________________________
②此工业甲醇中CH3OH的质量分数为__________。
19、(8分)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。
(1)常温、同压下,等体积的丙烷和丁烷完全燃烧恢复到原状态,生成二氧化碳的体积比为____________。
(2)已知丁烷的燃烧热(生成液态水)为2880 kJ/mol,1mol丙烷和丁烷(物质的量之比1:1)的混合气完全燃烧放出的热量为2550 kJ。写出丙烷燃烧的热化学方程式__________________________________________。
(3)标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为________。
(4)标准状况下,a L的某丙烷和丁烷的混合气体,在b L足量氧气中完全燃烧后,恢复到原状态体积为V L,所得气体体积V为(用a和b表示)_____________。
18、(8分)如下图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
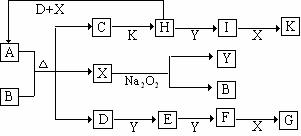
试回答下列问题;
(1)写出D(少量)、H、X反应生成A的化学方程式:________________________;
(2)写出D与K反应生成的正盐溶液中的离子浓度大小关系:________________;
(3)一定温度下,有可逆反应:aD(g)+bY(g)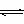 cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了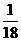 。则前2min内用E表示的平均反应速率为________mol·L
。则前2min内用E表示的平均反应速率为________mol·L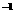 ·min
·min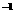 ,平衡时D的浓度为_________mol·L
,平衡时D的浓度为_________mol·L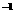 。
。
(4)已知:2H(g)+Y(g)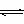 2I(g);△H=-196.6kJ·mol
2I(g);△H=-196.6kJ·mol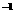 。当加入4mol H和2mol Y后,放出345 kJ的热时,H的转化率最接近于_______(填字母)。
。当加入4mol H和2mol Y后,放出345 kJ的热时,H的转化率最接近于_______(填字母)。
A、40% B、50% C、80% D、90%
17、(10分)已知:25℃时,A酸的溶液pH=α,B碱的溶液pH=b。
(1)若A为强酸,B为强碱,且a+b= 14,两者等体积混合后,溶液的pH=______,此时若溶液中阳离子浓度大于阴离子浓度,其原因可能是_________________;强酸强碱按体积比为1:10混合后溶液显中性,则a+b=_________。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为___________________________;混合后的溶液中,下列微粒浓度大小关系一定正确的是_________(填序号)
①c(MOH)>c(M+)>C(R-) >c(H+)>c(OH-)
②c(HR)>c(M+)>C(R-)>c(OH-)>c(H+)
③C(R-) >c(M+)>c(H+)>c(OH-)
④c(M+)>C(R-)>c(OH-) >c(H+)
⑤c(M+)+ c(H+)=C(R-)+c(OH-)
16、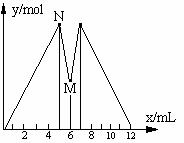 右下图是向MgCl2和AlCl3的混和溶液中加入NaOH溶液和盐酸时,沉淀的物质的量ymol与加入NaOH溶液和盐酸的体积x
mL的关系图,根据图示判断,下列结论中不正确的是( )
右下图是向MgCl2和AlCl3的混和溶液中加入NaOH溶液和盐酸时,沉淀的物质的量ymol与加入NaOH溶液和盐酸的体积x
mL的关系图,根据图示判断,下列结论中不正确的是( )
A、N点时溶液中的溶质只有NaCl
B、M点之前加入的是NaOH溶液,
M点之后加入的是盐酸
C、c(NaOH)=c(HCl)
D、原混合溶液中c(MgCl2):c(AlCl3)=1:2
第Ⅱ卷(非选择题,共62分)
15、下列说法正确的是( )
A、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(A2-)=c(OH-)+c(H2A)
B、0.020mol/L的HCN(aq)与0.020mol/L NaCN(aq)等体积混保得到碱性混合溶液中:c(Na+)>c(CN-)
C、在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol/L
D、c(NH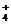 )相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:c[(NH4)2SO4]>c(NH4HCO3)>c(NH4Cl)
)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:c[(NH4)2SO4]>c(NH4HCO3)>c(NH4Cl)
14、容积相同的甲、乙密闭容器,甲为恒容,乙为恒压,分别充入2mol SO2和1mol O2,同时发生反应:2SO2(g)+O2(g)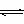 2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是( )
2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是( )
A、反应过程中甲容器中的反应速率比乙中的大
B、甲容器反应达到平衡时所需时间比乙容器少
C、乙容器SO2的转化率大于25%
D、平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2
13、有机物在酸性条件下发生水解反应时,生成两种不同有机物,且这两种有机物的相对分子质量相等。则水解前的这种有机物是( )
A、甲酸甲酯 B、乙酸异丙酯 C、麦芽糖 D、葡萄糖
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com