
题目列表(包括答案和解析)
8.下列各组离子,在指定的条件下能大量共存的是( )
A.滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl- 、NO3-
B.PH为11的溶液:S2-、SO32-、 S2O32-、Na+
C.水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.无色透明的溶液:K+、SiO32-、NO3-、Al3+
7.下列实验方案能达到预定目的的是
A、将SO2通入石蕊溶液中证明SO2有漂白性
B、用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱
C、向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42-
D.用干燥的pH试纸测得新制氯水的pH为2
5.下列有关叙述正确的是( )
 A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的导电性强
|
 H2O+NH2Cl,下列有关氯胺的说法不正确的是
H2O+NH2Cl,下列有关氯胺的说法不正确的是
A.氯胺的消毒原理与漂白粉相似 B. 氯胺的电子式为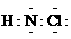
C.氯胺与浓盐酸混合可产生氯气 D. 氯胺在水中水解最初产物为NH2OH和HCl
4. 被誉为"太空金属"的钛,在室温下不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,这是因为 ( )
A.氢氟酸的酸性比其他酸强 B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强 D.钛离子易与氟离子形成可溶性难离解的物质
3.下列说法不正确的是 ( )
A.胶体能发生电泳现象是由于胶体粒子带电
B.HF的沸点比HCl沸点高,是由于HF分子之间存在氢键
C.SiCl4的熔点比SiF4的熔点高,是由于它们的晶体类型不同
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
2.“飘尘”是物质燃烧时产生的粒状飘浮物,颗粒很小(直径一般小于10-7m),不易沉降(可飘浮数小时甚至数年)。它与空气中的SO2、O2等接触时,SO2会部分转化成SO3 ,使空气中的酸度增加。在这种变化过程中,飘尘所起的主要作用是
A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
1.在2006年两会期间,许多代表认为环境污染已经成为当前中国发展中的一个重大问题。在一些生产和生活中产生的某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是
A.NO B.O3 C .CO2 D. 氟氯烃
22.(6分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
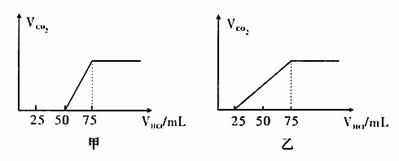
(1)试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 , 其物质的量之比是 ,产生的CO2气体体积(标况)是 。
(2) 乙所得溶液中存在的溶质是 。其物质的量之比是 ,产生的CO2气体体积(标况)是 。
21.(11分)
(1) 一透明溶液,已知其中可能含有Cu2+、Fe2+、Al3+、NH4+、HCO3-、K+、SO42-、Mg2+
。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:溶液中肯定有 离子,肯定没有 离子,可能有________离子
(2)在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变为蓝色,其反应的离子方程式为 ______________ 。在上述蓝色溶液中滴入足量的Na2SO3溶液,蓝色立即消失,其反应的离子方程式为 _________________ ,从以上实验可知,ClO-、I2、SO42-的氧化性由强到弱的顺序
_________________________。
(3)测定工业甲醇中CH3OH的质量分数可按下法:取0.1g工业甲醇样品,以适量H2SO4酸化后,加入20 mL 0.2mol/L的K2Cr2O7溶液,再用0.3mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②此工业甲醇中CH3OH的质量分数为
20、(10分)A、B、C、D、E、F均为短周期元素,原子序数依次增大。A元素原子核内无中子。B元素原子核外最外层电子数是次外层电子数的2倍。C元素是地壳里含量最多的元素。D是短周期元素中金属性最强的元素。E与D元素的质子数之和为27,最外层电子数之差为5。F元素的最高价氧化物的水化物为强酸。
(1)推断B元素在周期表中的位置:第 周期, 族。
(2)画出F元素的原子结构示意图: 。
(3)C、D元素可形成淡黄色的粉末,其电子式为: 。
(4)写出A与C元素形成10电子的微粒: 、 、 。
(5)D、E元素形成的正盐的水溶液中,阴离子的浓度大小顺序为:(从大到小排列)
。
(6)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量。写出反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com