
题目列表(包括答案和解析)
18.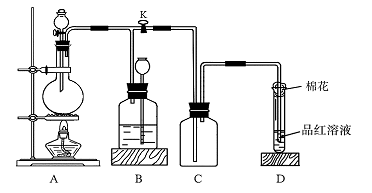 (11分)下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
(11分)下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题:
Ⅰ.(1)盛放药品前,检验此装置的气密性的操作方法和现象是:
_______________ 。
(2)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:_____________ 。
(3)装置D中试管口放置的棉花中应浸有一种液体,这种液体是________,其作用是:_______________________ _。
(4)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水; c.KMnO4酸性溶液 d.NaHSO3饱和溶液
Ⅱ.两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2.

试评价上述各方案是否严密,并说明理由:
。
17、(9分) (1) 下列有关实验操作或判断不正确的是 _________(填有关序号,选错倒扣分)。
A.用10 mL量筒量取稀硫酸溶液 8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液 19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
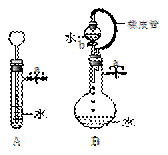 (2)根据右图描述回答下列问题:
(2)根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管
中注入一定量的水,静置后如图所示。试判断:A装置是
否漏气?(填“漏气”、“不漏气”或“不能确定”)
②关闭图B装置中的止水夹a后,开启活塞b,水不断
往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?
 (填“漏气”、“不漏气”或“不能确定”)
。
(填“漏气”、“不漏气”或“不能确定”)
。
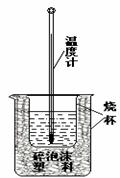
(3)实验室利用如右图装置进行中和热的测定。
回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”);原因是 。
16.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是
A.35g B.30 g C.20 g D.15 g
第一卷(选择题)答题表
第Ⅱ卷(非选择题:共52分)
15.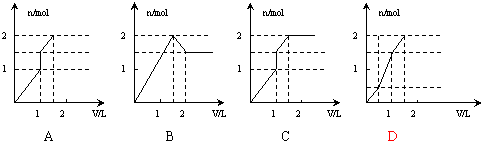 向含1mol HCl和1mol
MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
向含1mol HCl和1mol
MgSO4的混合溶液中加入1mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
14.下列离子方程式书写正确的是
A.二氧化硫气体通入到漂白粉溶液中:
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
B.硫酸镁溶液跟氢氧化钡溶液反应: SO4-+Ba+=BaSO4↓
C.硝酸亚铁溶液中加入少量的盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
D.FeC13溶液中通人足量H2S气体 Fe3++2H2S = Fe S↓+S↓+4H+
13.工业上从含硒的废料中提炼硒的一种方法是用硝酸钠与硫酸处理废料,得到亚硒酸和少量的硒酸,再加入盐酸共热,则硒酸转化为亚硒酸:2HCl + H2SeO4 ===H2SeO3 + Cl2 +H2O ,再将SO2通入亚硒酸溶液中出现单质硒沉淀。有关结论正确的是( )
A.H2SeO4的氧化性比氯气强 B.二氧化硒的还原性比二氧化硫强
C.析出1mol硒要用H2SeO3,SO2各1mol D.H2SeO3的氧化性比H2SeO4强
12.在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法不正确的是( )
A.该反应的化学方程式为4NH3+3F2=NF3+3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
11.周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),
如“Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可制得金属锂和氯气。若用
已潮解的LiC1加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无
味的气体。据此,下列说法正确的是
A. 无色无味的气体为电解生成的锂与水反应放出的H2
B.电解前LiCl在加热时未发生了水解
C.电解时产生的无色无味的气体是02
D.无色无昧的气体是阳极放出的Cl2与水作用生成的02
10.几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
K |
L |
M |
Q |
R |
T |
N |
|
原子半径/nm |
0.183 |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.152 |
|
主要化合价 |
+1 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
+1 |
下列叙述正确的是( )
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
9.由于碘是卤素中原子半径较大的元素,可能呈现一定的金属性。下列事实最能够说明这个结论的是
A.已经制得IBr、ICl等卤素互化物
B.已经制得I2O5等碘的氧化物
C.已经制得I (NO 3 ) 3 、I (ClO 4 ) 3•2H2O等含I3+ 离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com