
题目列表(包括答案和解析)
11.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器(如图)里,分别充有二氧化氮和空气,现分别进行下列两上实验:
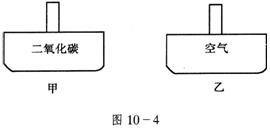
(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙(b)甲>乙 B.(a)甲>乙(b)甲<乙
C.(a)甲<乙(b)甲>乙 D.(a)甲>乙(b)甲=乙
10.下列各组离子,在指定的环境中,能大量共存的是( )
A.在pH=0的溶液中Na+、K+、MnO4-、Cl-
B.在c(H+)<c(OH-)的溶液中Na+、K+、S2-、SO32-
C.在中性溶液中Al3+、K+、SO42-、HCO3-
D.在酸性溶液中Fe2+、I-、Cl-、ClO-
9.某工厂排放的酸性废水中含有较多量的重金属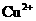 离子,这对农作物和人畜均有害.欲采用化学药剂法除掉有害成分,应选择下列药品中的( ).
离子,这对农作物和人畜均有害.欲采用化学药剂法除掉有害成分,应选择下列药品中的( ).
A.食盐和硫酸 B.铁粉和生石灰 C.胆矾和石灰水 D.苏打和硫酸
8.下列各组溶液,不加任何试剂(可加热)就可以区别的是( )
A.Na2S、Na2SO3、AgNO3、NaCl、NaOH
B.HCHO、CuSO4、NaOH、FeCl2、FeSO4
C.Br2、CH3CHO、CH3COOH、Ag(NH3)2Cl、NaHCO3
D.KAl(SO4)2、NaHSO4、Al2(SO4)3、KCl、MgCl2
7.2006年1月,我国研制出能在超低温状态下工作的镍氢电池。氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是:
H2+2NiO(OH) 放电充电2Ni (OH)2 , 根据此反应判断,下列叙述中正确的是( )。
A.电池放电时 ,电池负极周围溶液的pH不断增大 B.电池充电时, 镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2是正极
6.下列有关短周期元素的叙述中,肯定正确的是
A. 原子最外层电子只有1个或2个的元素是金属元素
B. 16号元素原子的最外层电子数是4号元素原子最外层电子数的四倍
C. 11号元素与17号元素能形成XY2型化合物

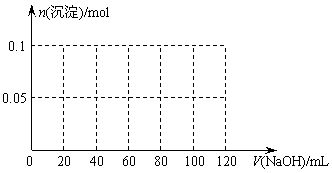
22.(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
 ⑵ 试通过计算确定该结晶水合物的化学式。
⑵ 试通过计算确定该结晶水合物的化学式。
⑶假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
21.(7分) (15分)下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志(图中部分反应物和生成物没有列出)。
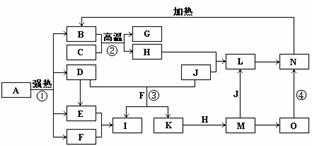
请按要求回答:
(1)写出L的化学式 ;
(2)写出:反应③的离子方程式 ;
反应④的化学方程式 ;
(3)反应②在工业生产上的用途是 ;
(4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1∶1∶1∶14,则反应①的化学方程式为 。
20.(7分)某待测溶液(阳离子为Na+)中只可能含有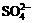 、
、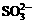 、Cl-、Br-、
、Cl-、Br-、 、
、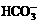 中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
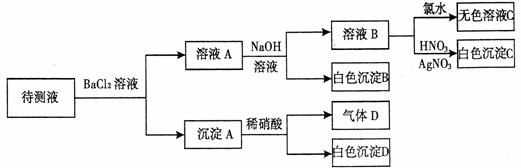
回答下列问题:
(1)待测液中是否含有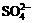 、
、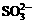 离子 。
离子 。
(2)气体D的化学式为 ,反应生成沉淀B的离子方程式为 .
(3)根据以上实验,待测液中肯定没有的离子是 ;肯定存在的离子是 。
19.(10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次递增。已知:A和C、B和D分别位于同主族,且B、D的质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。请回答:
⑴A2B和A2D的沸点较高者为 (填化学式),其原因是 ;
⑵由A、B、C、D四种元素形成的两种化合物相互间反应的离子方程式为
⑶写出由B、C二元素所形成的原子个数比为1︰1的化合物的电子式__________,其晶体中存在的化学键有____________________(填化学键名称)。
⑷用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后, 极(填电极名称)附近出现红色,另一极的电极反应式为 ,可用 检验该极所得产物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com