
题目列表(包括答案和解析)
22.(12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。
请回答下列有关问题:
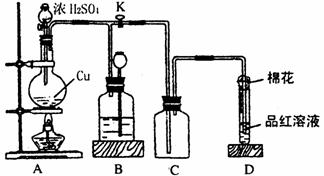
(1)装置A中发生的化学反应方程式为____________________________________________
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________________________,
其作用是______________________________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,
但由于余热的作用,A处仍有气体产生,此时B中现象是___________________________。
B中应放置的液体是(填字母)_____________。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol · L – 1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________________________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
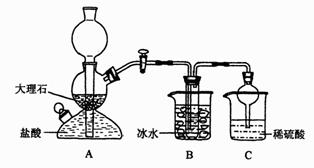 23.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,
23.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,
反应原理可用如下化学方程式表示:
NH3 + CO2 + NaCl + H2O == NH4Cl + NaHCO3↓
依据此原理,欲制得碳酸钠晶体,
某校学生设计了如下实验装置,其中
B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为: 。
C装置中稀硫酸的作用为: 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教
师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论:
。
 (5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为
。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为
。
21.(14分)水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气体中有CO和H2。(加热装置和导管等在图中略去)
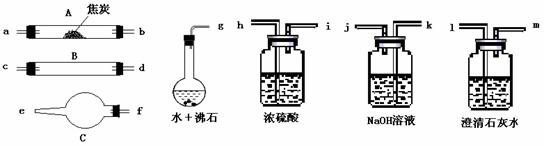
回答下列问题:
⑴ 盛浓硫酸的装置的用途是 ;
盛NaOH溶液的装置的用途是 。
⑵ 仪器B中需加入试剂的名称是: ,
所发生反应的化学方程式是: 。
⑶ 仪器C中加试剂的名称是: ,
其目的是 。
⑷ 按气流方向连接各仪器,用字母表示接口的连接顺序:
g-ab 。
⑸ 能证明混合气中含有CO的实验依据是
;
能证明混合气中含H2的实验依据是
_ 。
20.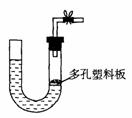 右图是气体制取装置,能用此装置制取气体并能“随开随用、随关随停”的是
右图是气体制取装置,能用此装置制取气体并能“随开随用、随关随停”的是
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.电石和水制取乙炔
第Ⅱ卷 非选择题部分(80分)
19、某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。下列有关该金属氧化物的应用的叙述不正确的是
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
18、下表中,对陈述I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
|
选项 |
陈述I |
陈述Ⅱ |
判断 |
|
A |
工业生产硫酸 用水吸收SO3 |
SO3可与水反应 |
I对;Ⅱ对;有 |
|
B |
Cl2和SO2混合后 可用于漂白纸浆 |
Cl2和SO2都有较好的漂白作用 |
I对;Ⅱ错;无 |
|
C |
金属钠具有强还原性 |
高压钠灯发出透雾性强的光 |
I对;Ⅱ对;无 |
|
D |
石墨常用作电解池的电极 |
石墨的化学性质稳定且导电性好 |
I对;Ⅱ对;有 |
17.对于难溶盐MX(弱电解质),其饱和溶液的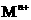 和
和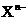 离子的物质的量浓度之间的关系近似于水的离子积
离子的物质的量浓度之间的关系近似于水的离子积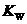 (
(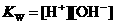 ,存在着
,存在着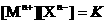 的关系(K为常数).现将足量的AgCl固体分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是( )
的关系(K为常数).现将足量的AgCl固体分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是( )
①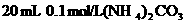 溶液 ②40 mL 0.03 mol/LHCl
溶液 ②40 mL 0.03 mol/LHCl
③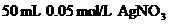 溶液 ④
溶液 ④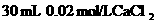 溶液
溶液
⑤10 mL蒸馏水 ⑥ 溶液
溶液
A.②>③>④>⑥>⑤>① B.①>⑥>⑤>②>④>③
C.①>②>③>④>⑤>⑥ D.③>②>④>⑥>①>⑤
16.下列实验现象的描述错误的是
A.氢气在氯气中燃烧生成绿色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
15.在密闭容器中,aA(g) 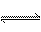 bB(g)
反应达平衡后,保持温度和压强不变,通入与反应混合物等物质的量的稀有气体,重新达到平衡时,B的浓度是原平衡时的60﹪。下列说法正确的是
( )
bB(g)
反应达平衡后,保持温度和压强不变,通入与反应混合物等物质的量的稀有气体,重新达到平衡时,B的浓度是原平衡时的60﹪。下列说法正确的是
( )
A.平衡向正反应方向移动 B.A的转化率减小
C.A的物质的量增加 D.a<b
14.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.该反应的化学平衡常数表达式为:K = 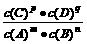
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q
C.若m + n = p + q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)mol
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
13.下列各溶液中,微粒的物质的量浓度关系正确的是 ()
A、0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-) B、0.2mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) C、0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合,
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D、c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液,
c[(NH4)2SO4]<c[(NH4)2CO3]<c( NH4Cl)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com