
题目列表(包括答案和解析)
5、实验室保存下列药品的方法,正确的是
A、氢氟酸贮存在细口玻璃瓶里 B、盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞
C、盛溴的试剂瓶里加一些水来防止溴挥发 D、少量碱金属单质都保存在煤油中;液氯贮存在钢瓶里
4.判断下列有关化学基本概念的依据正确的是
A、强弱电解质:溶液的导电能力大小 B、氧化还原反应:元素化合价是否变化
C、共价化合物:是否含有共价键 D、金属晶体:晶体是否能够导电
3、下列说法不正确的是
A、任何化学反应都伴随有能量变化
B、反应物总能量低于生成物的总能量时,该反应不能发生
C、反应物总能量高于生成物总能量时,发生放热反应
D、化石燃料在地球上的蕴藏量是有限的,而且又都是非再生能源
2、近日来,质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论。三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3 3HNCO;
8HNCO+6NO2
3HNCO;
8HNCO+6NO2 7N2+8CO2+4H2O,下列说法正确的是
A、C3N3(OH)3与HNCO为同一物质
B、HNCO是一种很强的氧化剂
C、1mol NO2在反应中转移的电子为4mol
D、反应中NO2是还原剂
7N2+8CO2+4H2O,下列说法正确的是
A、C3N3(OH)3与HNCO为同一物质
B、HNCO是一种很强的氧化剂
C、1mol NO2在反应中转移的电子为4mol
D、反应中NO2是还原剂
1.近年来,食品安全问题越来越引起社会的广泛关注,下列做法你认为正确的是
A、用硫磺熏制粉丝使它变白 B、用福尔马林浸泡海产品以保鲜
C、用苏丹红一号作为食品添加剂以改善食品色泽 D、腌制食品时严格控制亚硝酸钠的用量
28.(16分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)HX + 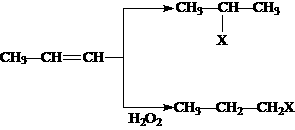 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被菌素原子取代。
工业上利用上述信息,按下列路线合成结构简式为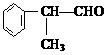 的物质,该物质是一种香料。
的物质,该物质是一种香料。
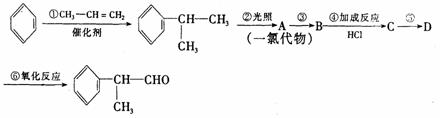
请根据上述路线,回答下列问题:
(1)A的结构简式可能为________________________________________________________。
(2)反应①、③、⑤的反应类型分别为____________、______________、_______________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
__________________________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______________________________________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:
①其水溶液遇FeCl3溶液呈紫色; ②分子中有苯环,且苯环上的一溴代物有两种。
写出符合上述条件的物质可能的结构简式(只写两种):
___________________________________________________________________________。
27.A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有1个电子。
(1)C原子的电子排布式为 ________ ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 ____ 键。
(2)当n=2时,B的原子结构示意图为 ______ , B与C形成的晶体属于 ___ 晶体。当n=3时,B与C形成的晶体中微粒间的作用力是 ;
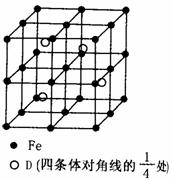 (3)若D元素与Fe形成某种晶体,该晶体的晶胞如右图所示。则晶体的化学式是____________ (用元素符号表示);若晶胞的边长为a nm,
(3)若D元素与Fe形成某种晶体,该晶体的晶胞如右图所示。则晶体的化学式是____________ (用元素符号表示);若晶胞的边长为a nm,
则合金的密度为______________g/cm3。
26、(14分)
(1)现有pH=2的HCl溶液100ml,要使它的pH = 3,如果加入蒸馏水,需加水_______mL;
如果加入PH = 4的HCl溶液,需加入此HCl溶液________mL。
(2)将pH = 8的NaOH溶液与pH =11的NaOH溶液等体积混合后,溶液的pH =_________;
(3)将0.1 mol/L 的HCl和0.06 mol/L的Ba(OH)2溶液以等体积混合后,该混合溶液的
pH = __________;
(4)25℃时,10体积PH = a的某强酸与1体积pH = b的某强碱混合后,溶液呈中性,
则a和b满足的关系_________________;
(5)用0.01 mol/LNaOH溶液滴定0.02 mol/L的硫酸,中和后加蒸馏水稀释至50mL,若滴定时终点判断有误差:①多加了1滴NaOH溶液,②少加了1滴NaOH溶液(设1滴为0.05mL);则①和②溶液中c(OH-)的比值是_______________;
(6)100℃时,Kw = 1×10-12,把0.001mol NaOH固体加入该温度下的水中配制成溶液1L,此溶液的PH =________________。
25.(8分)将1 mol I2 (g)和2mol H2 (g)置于某2L密闭容器中,在一定温度下发生反应:
I2(g)
+ H2(g)  2HI(g);△H < 0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
2HI(g);△H < 0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
(1)达平衡时,I2(g)的物质的量浓度为__________mol · L – 1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是________
 ①恒容条件下,升高温度
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2 (g)、b mol H2 (g) 和c mol HI (g) (a、b、c均大于0) ,发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c应满足的关系为_________________(用一个含a、b、c的代数式表示)。
24.(13分)用右图所示装置进行实验,将A逐滴加入B中:
(1)若A为浓硫酸,B为第3周期金属元素的片状单质,
其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色。
则B是_____________(填化学式),B与浓硫酸反应的化学方程式
为:_____________________________________________________;
反应后往烧杯中加入沸水,又可观察到试管C中的现象为:___________________________
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是________________________________________________。然后往烧杯中加入沸水,可观察到试管C中的现象是___________________________________________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_________, C是_______________与葡萄糖的混合液,仪器D在此实验中的作用是___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com