
题目列表(包括答案和解析)
7、下列叙述正确的是
A、48gO3气体含有6.02×1023个O3分子
B、5.6g Fe与足量的稀盐酸反应发生电子0.3 mol
C、0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D、标准状况下,33.6LH2O含有9.03×1023个H2O分子
6、1 g氢气燃烧生成液态水放出142.9 kJ热,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g)====2H2O(l);ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(l);ΔH=-571.6 kJ·mol-1
C.2H2+O2====2H2O;ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)====2H2O(l);ΔH=+571.6 kJ·mol-1
5、下列化学反应的离子方程式正确的是
A、用小苏打治疗胃酸过多: HCO3- + H+ == CO2↑+ H2O
B、往碳酸镁中滴加稀盐酸: CO32- + 2H+ == CO2↑+ H2O
C、往氨水中滴加氯化铝: Al3+ + 4OH- == AlO2- + 2H2O
D、氢氧化钡溶液与稀硫酸反应: Ba2+ + SO42- + H+ + OH- == BaSO4↓+ H2O
4、 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。
“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。有关说法正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。
“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。有关说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜(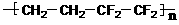 )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
3、氯气是一种重要的工业原料。工业上利用反应在3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A、若管道漏气遇氨就会产生白烟; B、该反应利用了Cl2的强氧化性
C、该反应属于复分解反应; D、生成1molN2有6mol电子转移
2、如果用排水法收集浓硝酸受热分解所产生的气体,则
A.收集到NO B.收集到NO2 C.收集到O2 D.收集不到任何气体
1、下列说法正确的是
A.SiH4比CH4稳定
B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
30、钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3→6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为________________g;
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为________________;
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L (标准状况),计算反应消耗的KO2的质量;
(4)KO2加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
衡阳市第八中学2009届高三第二次月考
29、某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
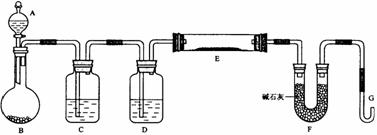
请回答下列问题。
(1)仪器中装入的试剂:B 、 C 、 D ;
(2)连接好装置后应首先 ,其方法是
;
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 。在这两步之间还应进行的操作是 ;
(4)反应过程中G管逸出的气体是_____________,其处理方法是______________________________________。
(5)从实验中测得了下列数据
①空E管的质量a ②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量) ④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):计算式1:Ar(W)= ;计算式2:Ar(W)= 。
26(8分)、某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。

(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
27(10分)、A、B、C、D、E、均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ AI3+
Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- 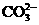 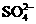 HCO3- HCO3- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别其他四种溶液反应,均有沉淀;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是A ;B ;C ;D ;E 。
28、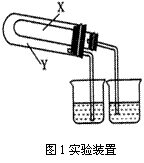 (11分)侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(11分)侯德榜是我国著名的工业化学家,又是一个伟大的爱国者,他所发明的制碱法为中国化学工业乃至世界化学工业作出了重要的贡献,被誉为“侯氏制碱法”。请你回答以下问题:
(1)“侯氏制碱法”中的“碱”其实不是烧碱,而是纯碱,请写出向它的溶液中滴加少量稀盐酸的离子方程式 。
(2)某同学为了验证NaHCO3和Na2CO3的稳定性,设计了如图1的实验装置,(铁架台、夹持仪器、加热装置等已省略,你认为在X中应放的物质是________。(填化学式)
(3)某化学研究性学习小组在老师的指导下,模拟侯德榜先生制碱原理设计了如图2的实验装置(图见下页)。
A.写出有关仪器的名称:a ,b 。
B.实验的操作步骤中,你认为打开旋塞K1、K2的合理顺序应为:先打开______, 后打开______,(填字母代号)简述理由 。
 C.在盛饱和食盐水的装置中发生反应的离子方程式为:
C.在盛饱和食盐水的装置中发生反应的离子方程式为:
,
装置中气胆的作用是 。
D. 工业上若需制备纯碱,则上述原料中除了饱和食盐水外,其它原料用工业常用方法制取,写出工业制备两种原料气的主要化学反应方程式。
_________________________________, ____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com